|
17. イメージングプレート(IP)によるダブルラベル試料の分析†
小幡年弘*, 岩本浩二**, 白岩善博***, 中島栄一***,河合賢司***, 進藤英世****
*筑波大学大学院生命環境科学研究科, **同大学生物科学系
305-8572 茨城県つくば市天王台 1-1-1
***三共(株)薬物動態研究所
140-8710 東京都品川区広町 1-2-58
****ラジオルミノグラフィ研究会
167-0042 東京都杉並区西荻北 4-17-12
Key Words :ImagingPlate(IP),double-labellingradioluminography(RLG),-rayprotector,selenium-75,sulfur-35,selenoproteins,carbon-14,tritium,double-labelling autoradiography, color-autoradiography
† Instruments for Radiation Measurement in Biosciences : Series 3. Radioluminography.
17. Analysis of Double-labelled Samples by the Imaging Plate (IP).
Toshihiro OBATA*, Koji IWAMOTO**, Yoshihiro SHIRAIWA***, Eiichi NAKAJIMA***, Kenji KAWAI*** and Hideyo SHINDO** :
*Graduate School of Life and Environmental Sciences, **Institute of Bio-logical Sciences, University of Tsukuba, 1-1-1 Tennoudai, Tsukuba-shi, Ibaraki Pref. 305-8572, Japan, ***Drug Metabolism and Phar-macokinetics Research Laboratories, Sankyo Co., Ltd., 1-2-58 Hiromachi, Shinagawa-ku, Tokyo 140-8710, Japan, **The Association of Radioluminography, 4-17-12 Nishiogi-Kita, Suginami-ku, Tokyo 167-0042, Japan.
1. はじめに
イメージングプレート(IP)は輝尽発光(PSL)現象を利用した二次元放射線分布検出器である。 IP はこれまでオートラジオグラフィに汎用されてきたX線フィルムに比べ, 露光時間が短い, 強度直線性に優れている, 検出感度が高いなどの多くの優れた特徴を備えている。 これらの特徴により実験時間は大幅に短縮され, 放射能分布の画像化がより容易かつ鮮明に行えるようになった。 しかし, IP の優れた特徴は単に利便性だけでなく, 実験の自由度の向上にもつながり, アイデア次第でさまざまな実験に利用可能である。 今回は同時に 2 種の核種を生細胞もしくは生体に投与し, IP の高いリニアリティと検出感度を利用することによって, ラジオアイソトープ (RI) ラベルされた生体試料の分析を行う実験法について, その実験例とともに紹介する。 なお, IP の原理, 技術的側面, 使用上の問題点, ハードおよびソフト面の機器利用法等については既刊および本シリーズ等ですでに紹介されているので参照されたい1)-7)。
2. 75Se/35Sダブルラベル試料の解析
2.1 実験の概要
ここではγ線放出核種である 75Se(E : 0.136MeV(58.3%), 0.265MeV(58.5%), 0.280MeV(24.8%), 0.401MeV(11.4%)) とβ線放出核種である 35S(Emax : 0.167MeV) によるダブルラベル実験および IP 上での両核種の分別法とその実際の利用例についてまず紹介する。 本法はβ線とγ線の物質透過力と飛程の差を利用し, 試料と IP の間に適当な遮蔽材を挟んで露光を行うことでγ線のみを検出し, 遮蔽材をセットしない場合に検出されるβおよびγ両核種によるラベル物質の定量的検出の比較から, おのおのの核種でラベルされた物質を検索する方法である (図 1 )。
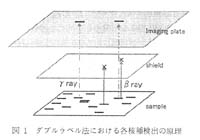
拡大 |
図 1 ダブルラベル法における各核種検出の原理 |
セレン (Se) は硫黄 (S) と同族の元素であり, 物理化学的性質が類似している。 そのため生体内では蛋白質中のシステインおよびメチオニンの硫黄と置換してセレノシステインおよびセレノメチオニンとして存在し, 動物においては必須元素として知られている8)。 与えられたセレンの生体内での挙動は硫黄のそれと類似しており, 置換される場合が多い。 セレン含有アミノ酸のうち, セレノメチオニンはメチオニン : tRNAmet リガーゼの基質となり, メチオニンの代りに蛋白質中へ取り込まれると考えられる。 一方, セレンが特異的に配位される物質もあり, おのおのの物質の機能にセレン置換が大きな影響を与える場合もある。 セレノシステイン含有蛋白質については, ポリペプチド鎖中のセリンまたはシステイン残基がセレノシステイン残基に変化する場合と, セレノシステインに特異的なコドンおよび tRNA が存在し, 蛋白質生合成の過程で直接蛋白質中に取り込まれる場合の二とおりの可能性がある。 実際, 後者については, 通常の終止コドンの一つである TGA によりコードされており, 蛋白質合成において 21 番目の蛋白質構成アミノ酸として認識されている9)。 また, セレンは硫黄に比べて還元力が強いという特徴があり, これが酸化還元酵素の活性に利用されている。 過酸化物の還元に働く酵素であるグルタチオンペルオキシダーゼでは, 活性の発現に活性中心のセレノシステインが必須であり, 動物のセレン要求性の原因となっている9)。
これらのことから, 生体内におけるセレンと硫黄の挙動は深く関連していることが予想され, 35S と 75Se のダブルラベル分別法の開発により, 生体内における硫黄およびセレン含有蛋白質の生理作用, および両元素の相互作用の解析がより容易になるものと期待できる。
2.2 75Se/35S ダブルラベル実験法
2.2.1 原理
同一膜試料上に混在するβ線放出核種ラベル物質, γ線放出核種ラベル物質およびβ/γ核種ダブルラベル物質を区別して検出するために, β線およびγ線の物質透過率の差を利用し, これを RLG 法で行うのが本法である。 実際に筆者らの実験に用いた方法は以下のとおりである。 ① 35S ( β線放出核種), および 75Se (γ線放出核種) の双方を同時, または一定の時間的経過を経て与える。 RI ラベルされた生体試料より抽出した蛋白質を SDS-ポリアクリルアミド電気泳動 (PAGE) で分離後, それらの蛋白質をブロッティング膜に転写し, 固定乾燥する。 その膜を試料としてユニバーサル型 (UR 型) の IP にコンタクトさせ, 密着露光させる (75Se および 35S 全ラベルバンドの検出)。 ② 同じ試料と IP の間にβ線を完全に遮蔽する薄い遮蔽材を挟み込み, 再び密着露光させる (75Se-ラベルバンドの検索)。 ③ おのおのの IP を BAS-5000 を用いておのおのの RI ポジティブバンドを検出し, おのおのの PSL 値を測定する。 ④ IP 検出画像を重ね合わせるなどのデータ解析を行う。 以上の操作によりダブルラベル物質を含む各 RI ラベル物質を検索する。
2.2.2 標準試料の作成
polyvinylidine difluoride (PVDF) 膜にγ線放出線源として約 20000cpm のNa275SeO3(5 L) (Se スポット) とβ線放出線源として約 20000cpm の Na235SO4(5 L) (S スポット) をスポットし, 試料として使用した (図 2F)。 クロストークを防ぐため, スポット間は 2cm 以上離し, 同一膜上に同じスポットを二つ並べて実験を行った。 RI 試料と IP の間に遮蔽材を挟んで数分間露光した後, BAS-5000 (富士フイルム, 東京) を用いて Latitude 4, S10000 でスポットを検出した。 放射線量の定量には FUJI FILM Science Lab98 Image Gauge ver. 3.1 (富士フイルム, 東京) を用い, 同一試料あたり二つのスポットの PSL 強度を定量し, その平均値を用いた。
2.2.3 最適な遮蔽材の選択
本法で求められる遮蔽材の必要条件はβ 線の透過率がゼロで,γ線の透過率が高いことである。 また, SDS-PAGE ゲル上の隣接する蛋白質のバンドの間隔は数 - 数百ミクロンである場合が多く, 厚みがあるとクロストークの原因となるため, IP と試料との密着性に関する影響を最小限にする薄膜が望ましい。 はじめに遮蔽効果の大きい厚さ 0.3mm の鉛板 (密度 340mgcm2, 千代田テクノル, 東京) を用いて実験を行った結果, 35S によるβ 線は完全に遮蔽され,γ線放出核種である 75Se のみが検出された (図 2 )。 遮蔽材なしのときには 75Se および 35S の双方を重ねたスポット (Se+S) の PSL 強度は, 75Se試料(Se)と 35S 試料(S)のスポットの合計になるが, 鉛の遮蔽によって Se スポットの PSL 強度と等しくなることから(図 3), 本法により,β線放出核種とγ線放出核種の両方でラベルした試料からγ線のみを検出することが可能である。
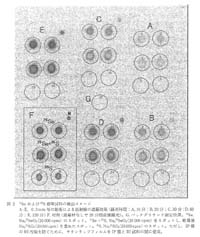
拡大 |
図 2 75Se および 35S 標準試料の検出イメージ
AE, 0.3mm 厚の鉛板による放射線の遮蔽効果 (露光時間 : A, 10 分 ; B, 20 分 ; C, 30 分 ;D, 60 分 ; E, 120 分) F, 対照 (遮蔽材なしで 20 分間直接露光)。 G, バックグラウンド測定位置。 75Se, Na275SeO3(20000cpm) のスポット。 75Se+35S, Na275SeO3(20000cpm) をスポットし, 乾燥後Na235SO4(20000cpm) を重ねたスポット。 35S, Na235SO4(20000cpm) のスポット。 ただし, IP 膜の RI 汚染を防ぐために, サランラップフィルムを IP 膜と RI 試料の間に使用。 |

拡大 |
図 3 鉛板による遮蔽効果
遮蔽なし () の場合と, 0.3mm 厚の鉛板で遮蔽した場合 () の Se スポットの PSL 強度をそれぞれ 100 としたときの他スポットの PSL 強度。 S, 35S のみ ; Se, 75Se のみ ; S+Se, 35S と 75Se を重ねてスポットしたもの。 |
鉛板を用いてβ線を完全遮蔽してγ線のみを検出することは可能であるが, 同時にγ線の約 80% も遮蔽効果により減少しており, 放射活性の低い試料では利用できない。 また, 試料と IP の距離が離れているため放射線の拡散が大きく, 画像が不鮮明になる。 そこで本法に最適な遮蔽材の検索を目的として鉛板, アクリル板 (厚さ 2mm, 密度 235mgcm2, 共和ガス化学工業, 東京), アルミ箔 (厚さ 25m, 密度 38mgcm2, ニッパク, 東京), 鉛箔 (厚さ 50 m, 密度 56.2mgcm2, 千代田テクノル, 東京), マイラーフィルム (厚さ 8 m, 密度 9mgcm2, アロカ社, 東京), ラミネートフィルム (厚さ 25m, 密度 23 mgcm2, アスカ, 東京) について検討した。 それぞれの遮蔽材に対して遮蔽材の厚さを変えて一定時間露光を行い, 直接露光したときの PSL 強度を 100%, バックグラウンドを 0 %として透過率を比較した (図 4A-F)。 前述のように厚さ 0.3mm の鉛板はβ線を完全に遮蔽し,γ線も約 80% 遮蔽した。 厚さ 50m の鉛箔でもγ線の約 70% が遮蔽された。 アルミ箔では 250 m まで十分なβ線遮蔽効率が得られず, このときγ線の約 60% が遮蔽され, 鉛と同様の傾向が見られたことから, 双方ともに遮蔽材としては不適当であった。 アクリル板は遮蔽効果が弱く,β線を十分に遮蔽するには 4 mm の厚さが必要であり, このときγ線も 60% 遮蔽された。 さらに放射線の拡散も大きく,遮蔽材としては不適切であった。 マイラーフィルムは 1 枚が 8 m と薄いにもかかわらず,β線に対して 10 枚で約 85% の遮蔽効果を示した。 このときγ線の遮蔽は約20% であり,拡散も少なく,本法に適していた。またラミネートフィルムは 1 枚で十分にβ線を遮蔽し,γ線の遮蔽は 30% であった。 マイラーフィルムやラミネートフィルムは制動放射線が発生しにくいので拡散が少なく, 物質密度が高いため高い遮蔽効率を示したと考えられる。 本法にはどちらも適していたが, 扱いやすさ, 入手の容易さから, 今回試験した中ではラミネートフィルムが最適であると判断した。
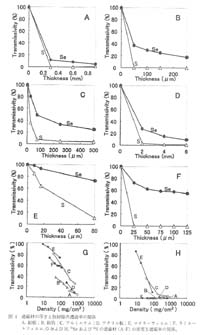
拡大 |
図 4 遮蔽材の厚さと放射線の透過率の関係
A, 鉛板 ; B, 鉛箔 ; C, アルミニウム ; D, アクリル板 ; E, マイラーフィルム ; F, ラミネートフィルム, G および H, 75Se および 35S の遮蔽材 (A-F) の密度と遮蔽率の関係。 |
2.3 75Se/35Sダブルラベル蛋白質の検出法の応用例
海洋性単細胞石灰藻 (円石藻) Emiliania huxleyi は細胞内の小胞中でコッコリスと呼ばれる CaCO3 結晶を合成し, それを細胞表面に配置するユニークな植物プランクトンである。 そして, ときに数千 km2 にも及ぶ大繁殖 (ブルーム) を起こすことから海洋における大規模 炭素循環媒介者として注目されている。 円石藻はその生育における必須微量元素としてセレンを要求することが見いだされており, セレンが増殖の重要な制御因子と推定されている10)11)。 筆者らは 75Se を用いたトレーサ実験を行い, セレンが特定の蛋白質中に含まれることを発見し, これをセレン要求性の原因と推定した。 しかし, 蛋白質へのセレンの取込みは, セレンに特異的な場合の他に, 硫黄との濃度比により含硫アミノ酸であるメチオニン, およびシステインに非特異的に取り込まれる場合がある。 後者の場合, 蛋白質中のセレンと当該蛋白質の機能は無関係であり, セレン要求性の原因とは考えにくい。 そこで蛋白質へのセレン取込みの特異性を確認するために本法による解析を試みた。
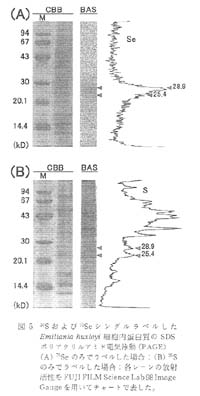
まず, シングルラベル法によるラベル蛋白質の検索を行った。 Na275SeO3 のみを含む培地で培養した細胞と, 35S-メチオニン/システイン (35S-MetCys, Pro-mix L-[35S] in vitro cell labelling mix, Amersham-Pharmacia) カクテルのみを含む培地で培養した細胞のそれぞれについて細胞から超音波破砕により蛋白質を抽出し, 細胞抽出液とした。 抽出液に対して SDS-PAGE を行い, ゲルを乾燥後, 75Se を含む試料は 15 時間, 35S を含む試料は 20 時間, 別々に遮蔽材を用いずに露光した (図 5 )。 蛋白質染色剤 (CBB) により検出されるバンドのうち 75Se でラベルされたバンドは 28.9 および 25.4kDa の二本であり (図 5A), 35S ラベル蛋白質は多数検出されたが 28.9 および 25.4kDa 蛋白質のラベルは他と比べ弱いものであった。 これより, この 28.9 および 25.4kDa の蛋白質が, 特に 75Se によってラベルされたセレン含有蛋白質 (セレノプロテイン) であると判明した。
|
拡大
|
図 5 35S および75Se シングルラベルしたEmiliania huxleyi 細胞内蛋白質の SDS ポリアクリルアミド電気泳動 (PAGE)
(A)75Seのみでラベルした場合;(B)35Sのみでラベルした場合 ; 各レーンの放射活性をFUJIFILMScienceLab98ImageGaugeを用いてチャートで表した。 |
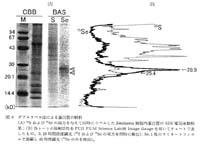
次に, Na275SeO3 および 35S-MetCys の両方を含む培地で培養した細胞について同様の取込み実験およびダブルラベル検出法による解析を行った。 まず, 75Se もしくは 35S によるシングルラベルバンドおよび 75Se/35S ダブルラベルバンドを検出するために遮蔽材を用いずに 20 時間露光した (S レーン, 図 6A)。 次に,β線の完全遮蔽のためにラミネートフィルムを乾燥ゲルと IP の間に挟み, 40 時間露光した (Se レーン, 図 6A)。 このとき, 別の 35S ラベル試料を用いて同様に露光し, 35S のβ線が検出されないことを確かめた。 PSL 解析結果を図 6B に示す。 75Se のみを検出したときに強くラベルされる 2 種 (28.9 および 25.4kDa) の蛋白質 (75Se, 図 6B) は, 35S と 75Se を同時に検出した場合 (35S, 図 6B) に比べ, 他の蛋白質よりわずかしかラベルされていない。 セレンの取込みが非特異的なものであるならば他の蛋白質にも 75Se のラベルが見られるはずなので, これら 2 種の蛋白質へのセレンの取込みがセレンに特異的であることが確認された。
|
拡大
|
図 6 ダブルラベル法による蛋白質の解析
(A) 35S および 75Se の両方を与えて同時にラベルした Emiliania 細胞内蛋白質の SDS 電気泳動結果 ; (B) 各レーンの放射活性を FUJI FILM Science Lab98 Image Gauge を用いてチャートで表したもの。 S, 20 時間直接露光 (35S および 75Se の双方を同時に検出);Se, 1 枚のラミネートフィルムで遮蔽し 40 時間露光 (75Se のみを検出)。 |
3. β線放出核種 (3H, 14C, 32P 等) のダブルラベルオートラジオグラフィ
薬物動態の分野では, 実験動物の個体差による変動要因を除去するために, ダブルラベル法が検討され, 特に多用される 3H ともう一つのβ線放出核種(核種)標識体を同一固体に投与し, 両標識体の体内挙動を同一試料上でダブルラベルオートラジオグラフィ法により識別観察する方法が実用化されている。 その原理は 3H (Emax : 0.018 MeV) ともう一つのβ核種 (たとえば 14C Emax : 0.155MeV) 等との間のように大きなエネルギー差を利用する方法が一般的である。 両者を識別観察する方法には, 色調の差で判別するカラーオートラジオグラフィ法12)と, RLG で遮蔽層のある場合とない場合で作成した二つの画像の差から両者を分別定量する方法 (ダブルラベル RLG 法)13) とがあり, これらについて以下に紹介する。
3.1 カラーオートラジオグラフィ法
3.1.1 原理
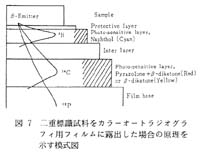
筆者 (中島) らが, 今から30年以上前に小西六 (当時, 現コニカ) の平田 明氏らと昼食を共にしていたときに, 二層の乳剤層を持ったカラーフィルムで, 3H などエネルギーの弱いβ核種は上層のみに感光して発色し, 一方高エネルギーβ核種は内層にも感光して別の色調で発色する, というダブルラベル専用のカラーフィルムができないだろうか, という夢が話題になった。 それから程なく, 小西六の研究スタッフによって 30 種類以上のフィルムが試作され, 最終的に見事なカラーオートラジオグラフィ用フィルムが誕生して夢がかなったのである。 図 7 にその原理の模式図を, また図 8 には色調を変えた 3 種類のカラーオートラジオグラフィ用フィルムについて構造と特徴を例示した。 表面には 1m の保護膜が塗布されており, 3H のβ線が透過できる程度の薄膜を均一に塗布するという難関を高度な技術でクリアしたことがうかがわれる。 上層にはβ線があたると青に発色するカラー乳剤層 (naphthol 発色層, 厚さ約 5m) が置かれ, その下にゼラチンの遮蔽層 (約 7m) を挟んでβ線により赤(pyrazolone発色層)あるいは黄色(β-diketone発色層) に発色する乳剤層 (内層, 12 m 厚) を置いた構造となっている。
|
拡大
|
図 7 二重標識試料をカラーオートラジオグラフィ用フィルムに露出した場合の原理を示す模式図 |
|

拡大
|
図 8 ダブルラベルオートラジオグラフィ用カラーフィルムの構造と特徴 |
すなわち, 3H(Emax : 0.018MeV) はほとんどすべてのβ線エネルギーを上層に落とし, 内層には到達しないので色調は青に染色される。 一方, 14C(Emax : 0.155MeV) など中程度のエネルギーの核種は, 上層に一部のエネルギーを落とすとともに, 内層に達してすべてのエネルギーを与えて紫または緑色に発色し, さらにエネルギーの大きい32P(Emax : 1.707MeV) などは上層への寄与は少なく大部分が内層で吸収されて赤または黄色に近い色に発色する。
3.1.2 応用例
図 9 には活性型ビタミン B1 誘導体である s-benzoylthiamine O-monophosphate(BTMP) の thiamine 部分を 3H で, リン酸部分を 32P で標識し, 仔イヌに経口投与 (3H : 611MBq, 32P : 300kBqbody) 後 24 時間にそれぞれの標識部分が体内でどのように分布しているかをカラーオートラジオグラフィで観察した結果を示した。 イヌは体重 600g のビーグル犬, 生後約 1 月で, 3H-, 32P-BTMP を経口投与後 24 時間に麻酔下でヘキサン-ドライアイス中に浸入して約 1 時間凍結し, CMC 抱埋後にクライオマクロトームで 50m 厚の全身切片を作成した。 切片は凍結乾燥し, さらに約 35 日間放置後にダブルラベルオートラジオグラフィ用カラーフィルム (Type24) に 2 週間露出した。 フィルムは所定の現像, 定着処理を行ってカラーオートラジオグラムを得た。
|
拡大
|
図 9 イヌに s-benzoylthiamine (thiamine-3H) O-monophosphate (phosphate-32P) を静注後 24 時間のカラーオートラジオグラム
青色 (3H, thiamine moiety) : 脳, 脊髄, 頚部や心臓の筋肉, 横隔膜などに, 赤とは独立して分布赤色 (32P) : 骨にリン酸部分が高濃度に分布紫色 (3H+32P) : 腸管粘膜, 肝臓, 胸腺は両核種が存在 |
イヌに投与時の 3H と 32P の投与量はそれぞれ 611MBq, 1.67MBq であり, 両者の比は約 370 : 1 であった。 切片作成後ただちに 2 週間露出した場合には画像の大部分が深い赤色に染められ, 3H に対して 32P が過剰に存在することが考えられたため, 32Pの減衰を待ち, 1000 : 1 以上の量比になった時点で得たオートラジオグラムがもっともバランスのよい結果を与えた。 特に二次核種として 32P を用いる場合には切片厚をなるべく薄くして 32Pβ線の寄与を少なくすることが効果的である。
図 9 に示されたように, 経口投与24時間後では青色 (3H) は脳, 脊髄, 頚部や心臓の筋肉, 横隔膜などに分布し, thiamine 部分がリン酸部分とほぼ完全に別れてこれらの組織に移行していることが観察された。 骨は濃い赤色に染められ, 遊離したリン酸部分が骨に取り込まれたことが示された。 一方, 腸管粘膜, 肝臓, 胸腺は紫色を呈しており, 両核種が存在することが示された。
3.2 ダブルラベル RLG 法
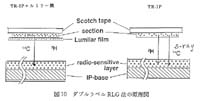
3.2.1 原理
IP システムが長年の懸案であった全身オートラジオグラフィ (WBA) の定量法にきわめて有効な手段であることを確認した1987年ころ14)には, 3H を検出できる IP はまだ開発されておらず, 汎用タイプの IP (BAS-MS2025 等, MS と略す) の保護膜層を剥離除去してラジオリガンドの脳受容体分布観察に応用していた。 しかし3H用として保護膜層のないIP(BAS-TR,TR-2025 等, TR と略す) が提供されて以来, ダブルラベル RLG を含めて応用性が著しく拡大されている。 ダブルラベル RLG 法の原理図を図 10 に示した。 すなわち TR に 3H と 14C のダブルラベル試料を露出し, トータルの放射能を検出した後に, 3H のβ線を適当な遮蔽物 (ルミラー膜, 東洋レーヨン/中川製作所扱い, 約 5 m 厚) を挿入して TR に再度露出し, 14C のみを検出し, さらにトータル画像から 14C を削除して 3H を求める, という手法を用いた。
|
拡大
|
図 10 ダブルラベル RLG 法の原理図 |
また実際に試料中放射能濃度を求めるためのスタンダード (STD) は手製および市販どちらでもよく, 各種 3H, 14C STD を TR に 24 時間露出した画像を図 11 に例示した。
|

拡大
|
図 11 3H, 14C スタンダードの TR 画像
A : X線フィルムに標準試料を染み込ませたものB,C : 市販の 3H スタンダード (ARC 社, プラスチック製) D : 市販の 14C スタンダード (ARC 社, プラスチック製)E,F : 市販の 14C スタンダード (Amersham 社, メタクリレート製) 露出 : 24 時間 |
STD はあらかじめ生体組織中濃度など目的とする単位に換算されており, 一定の条件下では 3H, 14C ともに PSL 強度と放射能濃度値の相関性は直線関係を示すことが確認されている。 そこでこれら関係式の範囲内であれば, 両核種それぞれの PSL 強度から組織中濃度等を求めることが可能である。
使用した STD の内訳は次のとおりである。
A : 手製の STD (未使用のX線フィルムを 3H, 14C 水溶液に浸し, 乾燥したもの)
B : 市販 3H-plastic STD (ARC 社 ART-123, glass slide) 濃度 : 0.518 - 18093kBqg-plastic の 13 段階
C : 市販 3H-plastic STD (ARC 社 ART-123PL, plastic strip) 濃度 : 0.518 - 18093kBqg-plastic の 13 段階
D : 市販 14C-plastic STD (ARC 社 ARC-146) 濃度 : 0.074 - 1295kBqg-plastic の 15 段階
E : 市販 14C-STD (Amersham 社, 14C-poly-methyl methacrylate) 濃度 : 1.11 - 32.34kBqg-organ (equiv.) の 7 段階
これら STD を直接 TR タイプの IP に密着し, シールドボックス内で 24 時間露出後, BAS-3000 で Latitude 4, S10000, R256 で読み取ってトータル放射能を測定した画像が図 11① である。 次いで同一試料をルミラー膜で覆って TR に再露出し, 同一条件で読み取って得た RLG を図 11② に示した。 ルミラー膜を用いない①の PSL 強度を 100% とすると, ルミラー膜を用いた②の相対強度は 3H が 0.13% に低下し, 一方 14C は 75% が検出され, 減弱率は少なかった。 WBA など実際の応用例においては, これを 100% に補正し, ①のトータル画像から差し引くことによって 3H の PSL 強度を求め, これらの STD で作図した PSL 強度/組織中濃度の補正式で放射能濃度に換算する。
3.2.2 3H14C-3-O-methyl-glucose 投与ラットの体内分布測定への応用
標識薬物の体内挙動を詳細に観察するには WBA が有効であるが, 2 種類の薬物を比較するにはダブルラベル WBA が動物の個体差の影響を除外できる点で優れた効果を期待できる。 モデル実験としてラットに 3H- および 14C-3-O-methylglucose をそれぞれ 18.5MBq, 925kBq (化合物として 30 g) 静脈内注入し, 1 分後にヘキサン/ドライアイス中で麻酔下凍結し, Ullberg の定法に従って厚さ 30m の全身切片を得た。 切片は凍結乾燥後に TR2040 タイプ (20×40cm) の IP に 96 時間露出して BAS-2000 にて読み取り (100m), 総放射能の RLG を得た (図 12A)。 次いで同じ切片をルミラー膜で覆い, 同条件で TR に露出して14C のみの RLG を得た (図 12B)。 図 12B の PSL 強度をルミラー膜なしの状態に補正した後, 両データを MCID 型画像解析装置 (Imaging Research―Micro Computer Imaging Device) を用いて減算処理し, 3H のみの画像として描出を試みた結果が図 12C である。
|

拡大
|
図 12 BAS-2000/MCID によるラットダブルラベル WBA の解析
3H(925MBqkg)/14C(18.5MBqkg)-3-O-methylglucose 静注 1 分後
A : 3H+14C (ルミラー膜なし), B : 14C (ルミラー膜あり), C : A-Bf(x)=3H
|
静注 1 分後では, 化合物はほとんど代謝されずに RI 原体のままで存在するので 3H と 14C の標識部位の差は現れず, 分布は同じパターンを示すと考えられる。 したがって両核種による PSL 強度のバランスは投与時の両者の割合によって決まる。 図 12 では, 3H の投与量を 14C の 20 倍に設定した場合には, PSL 強度は 14C に比べて 3H がかなり少なく観察されており, 両者がバランスよく描出される量比は肝臓や筋肉では 90 倍, 血液では 120 倍以上の 3H が必要なことがわかった。 この量比は化合物の体内動態によって異なるので, 実験ごとに最適投与量比を設定することが望ましい。
3.2.3 3H-diiodotyrosine endorphin および 14C-methionine への応用
もう一つの例としてマウス (20g) で 3H-diiodotyrosine endorphin および 14C-methio-nine のダブルラベル RLG を行った例を示す。 投与スケジュールを次に示した。
マウス 1 : 3H-diiodotyrosine endorphin (111MBqkg) 静注, 30 分後凍結
マウス 2 : 14C-methionine (3.7MBqkg) 腹腔内投与, 3 時間後凍結
マウス 3 : 14C-methionine (3.7MBqkg) を腹腔内投与し, 150 分後に 3H-diiodotyrosine endorphin (111MBqkg) 静注, 30 分後凍結
以下, 3.2.2 に記載した方法でダブルラベル RLG を行い, BAS-3000 MCID で解析した結果を図 13 に示した。
本実験では 3H/14C の投与量比は 130 であったが, 投与後凍結までの時間をずらすことによって両核種の PSL 強度をほぼ同レベルに調整した。
図 13C③ はダブルラベル画像から 14C を差し引いた 3H 画像であり, A① および C① に示した 3H 単独投与画像に類似したパターンが観察された。 すなわち血液, 肺などに筋肉を上回る分布が示されたのに対し, 中枢への分布は低かった。 一方, 図 13B③ に示したダブルラベル 14C 画像は 14C 単独投与 (A②および B②) 画像に類似し, 腎臓, 肝臓, 膵臓等に高く, 中枢にも分布した。
|

拡大
|
図 13 3H-diiodotyrosine endorphin/14C-methionine への応用
A : TR, ルミラー膜なし B : TR, ルミラー膜あり C : A-Bf(x)=3H, 3H の RLG 画像を描出① : マウス 1 (3H-diiodotyrosine endorphin, (111MBqkg) 静注 30 分)② : マウス 2 (14C-methionine (3.7MBqkg) 腹腔内投与 3 時間)③ : マウス 3 (14C-methionine (3.7MBqkg) 腹腔内投与 3 時間/3H-diiodotyrosine endorphin (111MBqkg) 静注 30 分) |
主要臓器についてシングルおよびダブルラベルのマウス RLG 画像で求めた組織中濃度の相関性を図 14 に示した。 両測定結果はよい相関性が見られたが, 図 13C② に見られるようにピクセル単位で差し引きをした画像では位置のずれによると思われる残像が組織の周辺などに明確に現れており, 今後の改善課題として残されている。
|

拡大
|
図 14 ダブルラベル群とシングルラベル群での組織中濃度の相関性 (BAS3000使用) |
4. 今後の展望および課題
2種の化合物の取込みパターンを同一生物試料上で比較できるのが本法のメリットである。 別々の試料で比較することも可能だが, 同一試料で行うことにより実験操作が簡略化でき, 個体差や実験条件の誤差を排除できるのでデータの信頼性も向上する。
今回の 75Se/35Sダブルラベル実験のように 2 種の核種がそれぞれγ線放出核種とβ線放出核種で, おのおののエネルギー差が大きく, エネルギーレベルも比較的高い場合, 取込みの相互作用の解析等に本法の応用が可能であると思われる。 また,β線放出核種同士であっても, 3H/14C のようにエネルギー量や飛程に差がある場合, それを利用して適当な遮蔽材を選択することにより有用な手法が開発可能であることが示された。
3H/14Cダブルラベル RLG 法の場合, IP の 3Hβ線に対する感度が 14Cβ線に比べて低いことが改善すべき重要な問題である。 さらに, 画像間の減算処理方法の改善が強く望まれる。
今回記述した 75Se/35Sダブルラベル法の場合, 定性的な解析に加え, 定量的な解析を導入することが不可欠である。 今後標準試料を作成し, 遮蔽材によるγ線の減弱率を求め, ソフト上の数値補正によりγ線強度を求めるシステム開発が必要である。 さらに, この方法によって検索し精製した蛋白質の解析が次の重要なステップであるが, 大学などではそれらに不可欠な分析機器がRI施設にかならずしも完備されていないことが別の面での解決すべき重要な課題となっている。
謝 辞
75Se/35S ダブルラベル実験にあたり有用なご示唆とご協力をいただいた金沢大学理学部和田敬四郎教授に感謝いたします。 また, カラーオートラジオグラフィ用フィルムを作成してくださったコニカ桑原義美博士, 故平田 明博士はじめ同社研究室の皆様に厚く感謝申し上げます。
文 献
1) 宮原諄二 : イメージングプレート―新しい放射線画像センサー―, 現代科学, 10月号, 29-36 (1989)
2) 栗原紀夫, 中島栄一 : 二次元放射能分布検出・定量・画像化システム,Radioisotopes,42,541- 548 (1993)
3) 中島栄一, 中畑則道 : ラジオルミノグラフィによる二次元放射能分布検出, 定量, 画像化システムの進歩, 同上, 44, 543-554 (1995)
4) 栗原紀夫, 中島栄一, 高橋千太郎 : RLG 技術利用研究者へのアンケート結果, 同上, 47, 864-871 (1998)
5) 中島栄一, 河合賢司 : ラジオルミノグラフィによる放射能測定の一般的技術に関して, 同上, 47, 953-965 (1998)
6) 森 啓司 : BASシステムに関する FAQs, 同上, 48, 48-62 (1999)
7) 長塚伸一郎 : 装置の面均一性と測定値の直線性のバリデーション, 同上, 48, 132-145 (1999)
8) 江崎信芳, 田中英彦, 左右田健次 : セレニウム, 活性酸素" (浅田浩二編), pp. 365-371, 共立出版, 東京 (1988)
9) Stadtman, T. C. : Selenocysteine, Annu. Rev. Biochem., 65, 83-100 (1996)
10) Danbara, A. and Shiraiwa, Y. : The requirement of selenium for the growth of marine coccolithophorides, Emiliania huxleyi, Ge-phyrocapsa oceanica and Helladosphaera sp. (Prymnesiophyceae), Plant Cell Physiol., 40, 762-766 (1999)
11) 檀原明子,白岩善博:円石藻Emilianiahuxleyiのセレン要求性と生育培地の選択, 日本海水学会誌, 53, 467-484 (1999)
12) 進藤英世, 中島栄一, 桑原義美, 平田 明, 杉田定男, Radioisotopes, 17, 433-440 (1968)
13) 中島栄一, 河合賢司, 古田嘉壮, 柴部禎巳, 薬物動態, 9, S411 (1994)
14) 中島栄一, 安川勝衛, 篠崎速雄, 松原行雄, 藤下繁人, 岡野伸一, 同上, 3, 747-760 (1988)
|

