9. デジタルマイクロラジオグラフィシステムによる骨形態観察
医薬品開発分野への応用
古田嘉壯, 福田邦昭
三共(株)分析代謝研究所
140-8710 東京都品川区広町 1-2-58
Key Words :
Imaging Plate, bio-imaging analyzer system, digital micro radiography, micro focus X-ray
Instruments for Radiation Measurement in Biosciences (Series 3: Radioluminography),
9. Application of Digital Micro Radiography System in the Bone Morphology. Yoshitake FURUTA and Kuniaki FUKUDA : Analytical and Metabolic Research Laboratories, Sankyo Co., Ltd., 1-2-58, Hiromachi, Shinagawa-ku, Tokyo 140-8710, Japan.
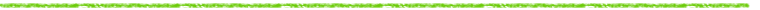
1. はじめに
ラットおよびマウスなどの小動物を用いた骨形態を対象に, 拡大画像をイメージングプレート (Imaging Plate : IP) で捉え, bio-imaging analyzer system (BAS) でデジタル化し, 画像解析を行うシステム, デジタルマイクロラジオグラフィシステム (digital micro radiography system: DMRS) が富士写真フイルムにより開発された。
従来, ラットおよびマウスなどの小動物の骨形態の観察には軟X線とX線フィルムを用いた方法で行われていた。 この方法は, 小動物の骨格はわかるが微小な部位の詳細な観察をするには限界があった。 しかし, 今回開発された DMRS は従来のX線フィルムに代えて超高感度放射線エネルギーセンサーであるIPの使用, および微小焦点サイズのマイクロフォーカスX線管の使用などにより, 従来法よりも少ない線量のX線を数秒照射するだけで, 鮮明なX線拡大画像を得ることができるようになった。 照射されるX線の線量が少ないため, マウスおよびラットなどの小動物を麻酔下の状態であれば, 生きたままの状態で鮮明な拡大画像を撮像することができ, 同一個体における経過観察が可能となった1)2)。
このシステムの基本原理, 撮像方法および利用例を以下に報告する。
2. デジタルマイクロラジオグラフィシステム(DMRS)の基本原理
2.1. DMRS
微小焦点サイズ 8μm のマイクロフォーカスX線管と, 検出器に IP を使用したX線撮像装置である。 軟X線とX線フィルムで行われていた従来法のX線源では焦点が 500 - 1000μm と大きく, 拡大撮像するとぼけた画像しか撮ることができなかった。 このため従来法ではサンプルとフィルムを密着して露光していたが, X線源にマイクロフォーカスX線管を用いた本システムでは, サンプルと IP の距離を離して拡大撮像しても, 鮮明な画像が得られるようになった。 本システムでは最大で 10 倍の拡大が可能である。 従来法との比較概念図を図 1 に示す。
|

拡大
|
図 1 X線フィルム法と DMRS との比較
従来法のX線源は焦点が大きく, ぼけた画像しか撮れなかった。 このためサンプルとフィルムは密着して露光していた。 しかし, X線源にマイクロフォーカスX線管を用いた本システムはサンプルと IP の距離を離して拡大撮像しても, 鮮明な画像を得ることができる。 |
2.2. イメージングプレート (IP)
IP は輝尽性蛍光体を用いた二次元放射線検出器である。 輝尽性蛍光体は, X線, 電子線, 放射線などで励起した後に, 比較的長波長の光で刺激すると, 輝尽発光 (photo stimulated luminescence: PSL) を示す。 輝尽発光とは, 放射線などの最初の刺激の後で, 発光波長よりも長波長の光による第二の刺激で再発光する現象をいう。 この特性を利用したのが IP である。 IP には発光センターとして 2 価のユウロピウムイオンを含有させたバリウムフルオロブロミド (BaFBr: Eu2) の微結晶が, ポリエステルフィルム上に 150 - 300μm の厚さに均一に塗布されている3)。 IP の断面構造を図 2 に示す。
放射線画像情報を読み取られた IP は, 可視光を均一に照射されることにより残存していたすべての情報が消去され, 繰り返し使用可能な状態に戻る。
放射線像を二次元的に検出する画像センターとして, もっとも利用されている写真フィルムと IP を比較すると次のようになる。 ①数十倍から数百倍感度が高い。 ②ダイナミックレンジが広い。 ③直線性がよい。 ④繰り返し使用できる。 ⑤露光は明室で作業可能なため暗室が必要ない。
5
2.3. Bio-imaging Analyzer System (BAS)
BAS は画像読取部と解析部に分かれ, 露光した IP を画像読取部で読み取り, 解析部で目的に応じた種々の解析を行うシステムである。
IP への露光は, 通常写真フィルムと同様にして行う。 露光された IP は画像読取装置内で, 図 3 のように搬送されながら, 633nm の He-Ne レーザービームで表面を走査される。 レーザー励起により生じた輝尽発光は, 集光ガイドにより光電子増倍管まで導かれ, アナログ電気信号に変換された後, デジタル信号に変換される。 そして, 解析部にて CRT 上の画像から目的とする画像処理, データ処理を行う。
本システムの撮像から解析までの流れは次のようになる。 サンプルをマイクロフォーカスX線のサンプルステージに固定し, 目的の倍率になるようにセットする。 あらかじめバックグラウンドを除いた IP を置き, X線の照射を行い, 照射後, IP を BAS で読み取り, デジタル信号に変換し, コンピュータ上で目的に応じた解析を行う。
|
拡大
|
図 3 IPからの放射線画像の読取り方法の原理
露光されたIPは搬送されながら He-Neレーザービームでその面上を走査される。レーザーにより発生したPSLは集光ガイドにより光電子増倍管まで導かれ, 電気信号に変換される。 |
3. 撮像方法
撮像方法は次の五つに分けられる。
①システムのセットアップ, ②IP の準備, ③サンプルの準備, ④撮像, ⑤BAS による読取り。
3.1. システムのセットアップ
マイクロフォーカスX線管はウォーミングアップが必要なため, 使用の際には必ず行わなければならない操作である。 このウォーミングアップは前回の使用時からの経過時間により所要時間が異なり, 前回使用時からの経過時間が 3 か月以上の場合, ウォームアップ時間は 2 時間以上必要となる。
3.2. IP の準備
前述のように IP は光を照射することで蓄積された情報を消去することができるので, 使用前には消去器にて蓄積されたすべての情報を消去してから実験に供する。 暗室内に DMRS を設置してあれば使用上不便は感じないが, 暗室までカセットにいれて運ぶ必要がある施設では DMRS 専用のX線の透過するカーボンプレート製のカセットを使用すると便利である (BAS で用いるカセットはX線があまり透過しないアルミニウム製)。
3.3. サンプルの準備
サンプルをサンプルステージ上に置き, 目的とする倍率になるようにセットする。 経過観察等で動物を生きたままの状態で使用する際には, 十分に麻酔をかけ, 目的部位が動かないようにテープ等で固定をする。 骨密度定量などの定量を行うときは標準濃度板をサンプルの隣に置いて同時に露出を行う。
3.4. 撮像
管電圧, 電流および時間を設定し, サンプルステージおよび IP を所定の位置に置き, スタートスイッチを押す。
3.5. BAS による読取り
X線照射完了後, IP を取り出し, BAS により読取りを行う。 読取り用の機種は数種類あり, それぞれの機種により画素数および階調数が異なるので, 目的に応じて読取り機を選択する必要がある。 一般に, 鮮明な画像を得るには画素数を少なく, 階調数を大きく設定する。
4. システムの応用例
本システムは前述のように高感度, 高解像度の特性を有する IP を検出器として用いるため, 照射するX線量を少なくすることが可能である。 これにより実験に供する動物を麻酔下であれば生きたままの状態で使用できるのが大きな利点といえる。 また, 鮮明な拡大画像が得られるので, 従来法では困難であったマウスおよびラットなどの小動物における骨形態を観察することが可能である。
適用分野の代表的な例を次に示す。
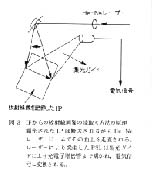
4.1. ラット胎児 20 日齢 (図 4 )
胎児の体長は 3 - 4cm ほどだが, 骨格は鮮明な画像として観察することが可能である。 従来このような胎児の骨形態を観察するには, 妊娠動物を帝王切開して胎児を取り出し, 固定後, 組織切片を作製, 染色を施し観察を行っていたが4), 本システムを用いることで大幅な時間短縮が可能となる。
|
拡大
|
図 4 ラット胎児 20 日齢 ( 4 倍拡大)
体調わずか3-4cmほどの小さな胎児でも鮮明な骨格像を観察することが可能である。 |
4.1.1. 撮像方法
サンプルをサンプルステージに固定し, X線の照射を行うだけの操作である。 IP への拡大倍率は 4 倍で行った。
4.1.2. X線の照射条件
管電圧 25kV, 電流 70μA, 時間 20 秒の条件でX線を照射した。
4.1.3. BAS の読取り条件
機種は BAS-5000 を使用し, Grad: 65536, Res: 25, Sens: 4000, Lat: 4 の条件で読取りを行った。
4.2. アジュバント関節炎ラットの同一個体における骨病変部の経時的変化
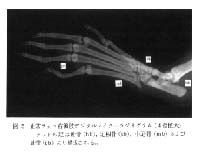
図 5 はアジュバント接種前, つまり正常な状態の右後肢像である。 足の骨は踵骨 (hb), 足根骨 (tb), 中足骨 (mb) および趾骨 (pb) より構成されている。 踵骨の骨密度などを鮮明な画像として観察することができる。
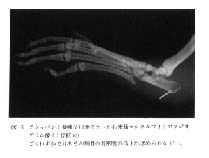
図 6 はアジュバント接種後 7 日目の像である。 踵骨のごくわずかな骨密度の低下が観察できる(↑)。 このような微細な変化は従来法の軟X線を用いた方法では観察の非常に困難なものであった。
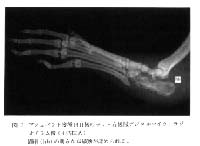
図 7 はアジュバント接種後 14 日目の像である。 踵骨 (hb) の明らかな破壊像が観察された。
図 8 はアジュバント接種後 21 日目の像である。 骨破壊はさらに進展し, 中足骨 (mb) にまで破壊が及んでいた。
|
拡大
|
図 5 正常ラット右後肢デジタルマイクロラジオグラム ( 4 倍拡大)
ラットの足は踵骨 (hb), 足根骨 (tb), 中足骨 (mb) および趾骨 (pb) より構成される。 |
|
拡大
|
図 6 アジュバント接種 7 日後のラット右後肢デジタルマイクロラジオグラム像 ( 4 倍拡大)
ごくわずかではあるが踵骨の骨密度の低下が認められる (↑)。 |
|
拡大
|
図 7 アジュバント接種14日後のラット右後肢デジタルマイクロラジオグラム像 ( 4 倍拡大)
踵骨(hb)の明らかな破壊が認められる。 |
|
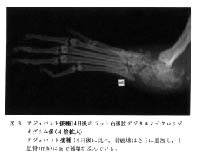
拡大
|
図 8 アジュバント接種14日後のラット右後肢デジタルマイクロラジオグラフィ像
アジュバント接種 14 日後に比べ, 骨破壊はさらに進展し, 中足骨(mb)にまで破壊が及んでいる。 |
図 5 - 8 のように, 同一個体で経時変化が観察できることは薬効薬理試験などでは非常に有効な手段となる。
アジュバント関節炎ラットは, 慢性関節リウマチのモデル動物として利用されている他, 抗炎症剤および免疫調整剤のスクリーニングモデルとしても利用されている5)6)。 ヒト関節リウマチは単純X線検査, X線 CT, MRI および骨塩定量法などをいくつか組み合わせた画像診断法が行われている6)。 しかし, アジュバント関節炎モデルのような小動物ではこれらの画像診断法を利用することは現段階では非常に困難である。 現在, 一般に行われている画像診断法としては軟X線を用いたX線撮影法があるが, この方法では撮影の際, 各時点で動物を殺し軟X線を照射し, X線フィルムを現像して行われている。 このため, この軟X線を照射する方法では, 同一個体で経時的な変化を観察することは不可能であり, 今回のような実験を行うためには個体差を考慮し, 例数を増やさなければならず, 使用する動物の数は実験期間が長くなれば必然的に増加する。 一方, DMRSは同一個体で経時的な観察が行えるため, 動物数は必要最小限に留めることができる。
4.2.1. アジュバント関節炎ラットの作製
方法
Winder ら7)の方法に準じて実施した。 アジュバントとして Mycobacterium butyricum の加熱死菌をめのう乳鉢で微細化後, 2mgml となるように乾熱滅菌した流動パラフィンに懸濁させ, さらに超音波処理して作製したものを用いた。 接種はラットの右後肢足踵皮内に Mycobacterium butyricum の加熱死菌として 100μg0.05mlpawを注射して関節炎を惹起させた。 アジュバントの接種開始日から 1 週間ごとに撮像を行った。
4.2.2. 撮像方法
ラットにネンブタール注射液をペントバルビタールナトリウムとして 20mgkg を腹腔内投与することにより麻酔し, サンプルステージに固定した。 サンプルの IP への拡大倍率は 4 倍で行った。
4.2.3. X線の照射条件
管電圧 25kV, 電流 80μA, 時間 20 秒の条件でX線を照射した。
4.2.4. BAS の読取り条件
機種は BAS-2000 を使用し, Grad: 1024, Res: 100, Sens: 4000, Lat: 4 の条件で読取りを行った。
5. おわりに
ここに挙げた応用例からもわかるように, 本システムの適用分野として, 関節炎などの骨形態変化を伴うモデル動物 (アジュバント関節炎ラット, コラーゲン関節炎マウスなど6)) を用いた薬効研究, 催奇形性試験などの毒性研究, 骨粗鬆症研究などが考えられる。
今後, 本システムの適用分野の拡大, 発展が期待される。
文献
1) 三浦研二, 江藤雅弘, 長島眞喜子, 大岡留里子: Application note No. 1, μFX-1000 の基本的知識, 富士写真フイルム株式会社, Oct (1998)
2) 古田嘉壯, 前田尚之, 江藤雅弘, 福田邦昭: デジタル・マイクロラジオグラフィシステムの骨形態学への応用, バイオイメージング 8, ( 1 ) 49 (1999)
3) 宮原諄二: イメージングプレート―新しい放射線画像センサー―, 現代化学, Oct., No. 223, 29-36 (1989)
4) 榎本 真, 林 裕造, 田中寿子編: 実験動物の病理組織", 315 骨格異常検査のための骨格標本の作り方, pp. 168-170 ソフトサイエンス社 (1980)
5) 京極方久, 安部千之編: 関節炎モデル動物" 医歯薬出版 (1985)
6) 松井宣夫, 杉本勝正: 慢性関節炎リウマチにおける骨病変の画像診断, Clinical Calcium, 3,( 8 ), 24-30 (1993)
7) Winder, C. V., Lembke, L. A. and Stephens, M. D.: Comparative bioassay of drugs in adjuvant-induced arthritis in rats: Arthritis Rheum., 12, 472-482 (1969)
|

