|
5.全身オートラジオグラフィとガイドラインの歩み†
進藤英世
ラジオルミノグラフィ研究会
152-8691東京都目黒郵便局私書箱25号
Key Words: who1e-body autoradiography, radioluminography (RLG), guide-line, tissue distribution study, ICH, quantitative autoradio-graphy
†Instruments for Radiation Measurement in Biosciences: Series 3. Radioluminography.
5. Whole-body Autoradiography in Japanese Guidelines-a Historical View-.
Hideyo SHIND0: Vice President, Association of Radio-luminography, Meguro P. O. Box 25, Tokyo 152-8691, Japan.
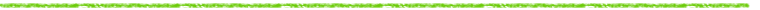
はじめに
全身オートラジオグラフィは標識薬物や農薬の動物体内での動きを的確に捉える優れた方法として用いられてきているが,医薬品の研究開発に果たす役割は時代の流れと国際化,学問の進歩に伴って変化し,それはガイドラインによる取扱いに端的に表れている。昨平成10年6月には,わが国の非臨床薬物動態試験の新しいガイドラインが発布されたが,本稿では,今まで主として著者が関係してきたガイドライン関連の流れを年譜的に振り返ることにより,今後Radioluminographyによる定量的全身オートラジオグラフィのより効率的な活用を考える上での何かの参考になれば幸いである。
1. 医薬品開発と組織分布試験
わが国で新薬の開発,許可申請に当たって体内での蓄積性の有無が特に重要視された端緒は,1960年代に見いだされた農薬の蓄積(残留)毒性にあったと思われる。筆者らは殺虫剤BHCのα,β,γ3異性体の体内分布を全身オートラジオグラフィにより比較し,1970年(昭和45年)に本誌に発表した1)。図1には14C体をマウスに腹腔内注射した24時間後の全身オートラジオグラムを示した。すなわち殺虫作用の本体であるγ体は体内から速やかに消失するが,α体のみは中枢に高濃度に移行し,中枢性の急性毒性に対応すると考えられた。一方,動物に強い肝毒性をもたらし,そのためにBHCの使用が世界的に禁止される流れを加速したβ体は,全身の脂肪組織に高濃度に取り込まれて貯留し,これが数か月にもわたって持続し,徐々に肝臓に移って行くことが示された。同様な蓄積はDDTについても明らかにされ,特定臓器への蓄積性が薬物についても特に重要視された。同時に,全身オートラジオグラフィが体内挙動を検出する上で画期的な方法であることが認識された。
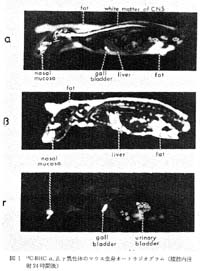
一方,分布と薬効の関係を示す一例として,1970年代初めに当時パーキンソン病治療薬として脚光を浴びたL-DOPA(脳内ドパミンの前駆体)の開発に際し,L-DOPAの分布をその対象体であるD-DOPAの分布と比較,研究した例を挙げる。図2は14C体をラットに静注投与後のオートラジォグラムを比較した一例で,L-DOPAのみが脳に移行し,D-DOPAおよびdopamineは移行しないことが明瞭に示された2)。当時L-DOPAの経口投与には大量投与が必要とされたが,これは末梢の脱炭酸酵素が飽和されて初めて血中にL-DOPAとして循環するためで,低投与量の分布像はdopamineの分布像となり,高投与量で初めて脳への移行が認められた3)。したがって,治療薬としては末梢性のdecarboxy1ase inhibitorとの併用が進んだ。図3は猫に阻害剤を前投与後のL-DOPA-14C経口投与後の脳オートラジオグラムで,放射能の線状体への局在(dopamineとして)を明瞭に示した4)。
拡大 |
図1 14C-BHC α,β,γ異性体のマウス全身オートラジオグラム(腹腔内注 射24時間後) |
拡大 |
図2 14C標識L-DOPA(上段),D-DOPAおよびdopamine(下段)のマウスオートラジオグラム (静注30分後) |
拡大 |
図3 L-DOPA-2-14C経口投与後のネコ脳オートラジオグラム(酵素阻害剤前投与,1および6時間) |
2. 新薬申請資料(旧ガイドライン)と全身オートラジオグラフィ
新医薬品について吸収,分布,代謝,排泄に関するデータが要求されることになったのは昭和42年であるが,昭和50年(1975年)には分布試験の重要性が反映され,厚生省通達による留意事項として表1の資料が要求されることになった。すなわち分布に関しては,"オートラジオグラフィの写真から分布傾向について十分な説明を行うこと",と"原則として連続投与による主要臓器への蓄積性について検討すること",の2点である。これらが後のガイドラインの制定とそれに続くいわゆるフォーマットの作成に際してもほぼそのまま取り入れられ,かつこれがすべての薬物に対して要求されると見なされたことから,国際的にも過重な試験として批判と議論を呼ぶことになった。
昭和62年,当時の政府による審査基準の透明化プログラムの一環として厚生省ガイドライン研究班が,東京薬科大学の粟津教授を委員長に設置され,筆者も企業からの協力委員としてこれに参加した。その際,日本製薬工業協会の基礎研究部会の中に「吸排試験検討プロジェクトチーム」を作っていただき,バックアップをしていただいた。なおこれが後に薬物動態試験に対処する第4分科会として発展し,現在は100社近い企業が参加,活動している。このような経過を経て平成元年の夏にガイドライン案が公表され,国内外の意見を聴取した後,平成3年1月(1989年)に厚生省から通達された。分布については先述の留意事項がそのまま取り入れられ,表2に示すように全身オートラジオグラフィと組織内濃度の測定の両方を行うことと,反復投与して蓄積性の有無を調べる(注7),というものである。本来ガイドラインは"一般的な考え方を示す指針"であり,本文中にはその趣旨が記されているが,実際には企業,行政ともにこれがすべての薬物に適用されるものと受け取られ,さらに注7の反復投与の規定は本来組織内濃度だけに言及したはずが,胎児内分布のオートラジオグラフィなどすべてに行われるようになり,これらの点は特に欧米から反撥を買うようになった。
このような指摘や疑問は国際学会での質問となって現れ,たとえば1988年に神戸で開かれた国際薬物動態学会では,わが国のADME試験について筆者が企業サイドから講演し,連続投与組織分布試験がいかに多くのresourceを使うかを示し,われわれはADME試験をより実質的なものにする努力が必要であることから,新しいガイドラインがrigidなものではなく,flexibleに運用されることを希望した。また,当時radio1uminographyは未だ確立されていなかったが,将来の方向として定量的オートラジオグラフィがこれらの試験の一部を代替できるのではないか,との提言を行った。しかし欧米からの出席者の納得は得られなかったことを思い出す。

拡大 |
表1 新医薬品の製造(輸入)承認申請に際しての留意事項(厚生省通達,昭和50年3月) |
|

拡大
|
表2 薬物動態試験ガイドライン(平成3年1月) 検討項目-2 分布 |
3. ICH(国際調和会議)と反復投与組織分布試験ガイダンス
このガイドライン公表とほぼ時を一にして1989年には,新薬の許可基準を国際的に統一し,より効率的に新薬を人類に提供する趣旨で米欧日三極の産官による国際会議,ICH(International Conference on Harmonization of Technical Requirements for Registration of Pharmaceuticals for Human Use)がスタートした。動態試験の分野では,翌1990年の東京でのEWG(専門家)会議において"トキシコキネティックス",これは毒性試験に組み込まれる形で薬物への曝露を保証する目的で欧米ではすでに実施が始まっていたものであるが,それとともに"反復投与組織分布試験"がトピックスとして欧米から提案され,わが国もこれを受けることとなり,筆者も製薬協の代表として専門家委員の一人としてガイダンス作りに当たった。当初欧米からはこの試験項目の削除が提案されたが,まず製薬協でアンケートを行った結果,表3に示すようにこの試験がまったく無意味と考えている企業は少なく,ただしすべての化合物にではなく,ある条件下で実施すべきである,との意見が多いことが明らかとなり,これを主張した。その結果われわれがガイダンス案を作ることになり,わが国でそれまでに実施,報告された約200例についての製薬協グループによる調査結果などを基にして学界にも参加していただいて,反復投与が必要となる条件の検討を行った。
|

拡大
|
表3 RIを用いる反復投与組織分布(蓄積)試験の有用性に関するアンケート調査結果(日本製薬工業協会,1992年10月実施,59社中55社より回答) |
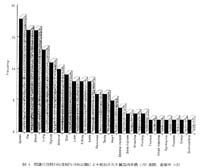
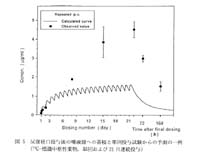
調べた総数197の薬物についての内訳は,連続投与によりいずれかの臓器,組織に蓄積が検出された薬物は,単回投与に比較して係数10以上の著しい蓄積が32例,3以上のものを合わせると64例に及んだ。これがどこに蓄積したかを分類した結果,図4に示すとおりで,脾臓,脂肪組織,血液(血球と思われる),肺,甲状腺,副腎,動脈壁,という順序であった。これらについて単回投与からの予測性を調べた結果,消失半減期が50時間以上に長くなると蓄積の可能性が高く,かっ単回投与からの予測性が低くなる傾向がわかった。そのような一例を図5に示す。この例では予測値の3倍以上の蓄積を示しており,実際には定量的オートラジオグラフィによって十分確認できると思われる。なおこれらの結果は理論的考察を含めて溝尻により報文化されている5)。
結局,表4に示す三つの条件(第4はtargetting製剤に対するもの)に当てはまる場合にのみ反復投与試験の実施を考慮することになった。実際に最も起こり得る条件としては,単回投与の分布試験から,ある臓器からの消失半減期が血液中からの消失よりも明らかに長く,かつ48時間を超える場合で,このときは実際に反復投与試験でこれを確かめることになる。また試験デザインについても大幅にcase by caseの形とされ(表4),これらは1993年のオーランドでのICH-2で提案されてStep-2の合意に達した。この会議でそのscientific back-groundを示すのが筆者の役目となり,それまでの調査結果を報告したが,このICHの議論を通じて欧米からは,組織計数法に替わって定量的オートラジオグラフィの使用についての強い要望があった。そこで,この講演6)と同年春に二一スで行われたToxicokineticsに関するDIA Meeting7)の中で1991年に発足したRLG研究会に触れ,Imaging Plateの高い感度とdynamic rangeの広さ,counting dataとの相関性のデータ8)を提示し,Imaging Plateを用いる定量的AR法が従来の組織計数法のよい代替法になり得ることを強調した。また会場から一時点に必要な例数の質問があり,それはその目的に応ずるだろうが,たとえば反復投与による蓄積や消失の程度を見るには一時点1例で経時的または経日的に繋げることで十分ではないか,と返答した。このICHガイダンスは平成6年10月に最終合意(Step4)に達し,そのままわが国の基準として平成8年7月に厚生省から通達された。
拡大 |
図4 標識化合物の反復投与分布試験により検出された臓器内蓄積(197薬物,蓄積率>3) |
拡大 |
図5 反復経口投与後の唾液腺への蓄積と単回投与試験からの予測の一例(14C一標識中枢性薬物,単回および21日連続投与) |

拡大 |
表4反復投与組織分布試験ガイダンス(Guidance for Repeated Dose Tissue Distribution Studies, Step4 Document of the lCH Processes, 26 0ctober 1994, Brussels) |
4. ICHと新薬開発の効率化
新薬開発の効率化を求める動きは最近とくに米国で顕著であり,動物試験は最小限に留め,少しでも早くヒトに直接投与して動態を調べる方向に動いている。その典型例がICHのTopicM-3"医薬品のヒト臨床試験の実施のための非臨床試験の実施時期"で,1997年暮れに難産の末Step2となり,翌年のICH4でStep 4の合意に達したものである。一番のポイントは最初のヒト試験に入るためにどのような試験が必要か?という点であり,表5に示すように未だ三極間の差が最も大きいものである。ヒトに初めて単回投与する毒性試験の条件として,わが国ではゲッ歯類4週,非ゲッ歯類2週毒性,EUと米国はゲッ歯類,非ゲッ歯類ともに2週でよい,とするものである。さらに,1998年の春FDAから突如出てきた指針が,"米国では単回投与毒性試験でヒトヘの単回投与ができる",というものである。

拡大 |
表5 臨床試験を実施する際に必要とされる反復投与毒性試験期間(Step 2) |
最大の食い違いの原因はPhase Iに対する考え方の違いにある。すなわちわが国は通常十分な動物実験を行って一つの候補化合物に絞り込み,いったんPhase Iに入ると,単回投与,dose escalation,反復投与,の試験を一括して行うのが普通である。これに対して米国ではPhase Iをいくつかのstepにわけ,その最初はinvestigationalまたはscreening phase Iといわれ,いくつかの化合物について治療レベルより低い用量でヒトの体内動態,主として血中濃度と半減期を調べることにより,開発に進む化合物一つを選択するというものである。次の第 2段階で初めて一つの化合物についてのclinical pharmaco1ogy試験を行い,ここでPK/PDの性質が細かく調べられ,後述する動物との比較が必要となる。第3段階で初めて用量が上げられ,dose rangeやside effectなど,ヒト安全性についての初期情報が調べられる。言い換えると候補化合物のスクリーニングもヒトでできるだけ早期に行って無駄をなくすというきわめて合理的な試験法である。
したがってまた,Phase Iに入るために必要な動物ADME情報にも大きな差が生まれ,表6は1994年に製薬協84社に行ったアンケート結果で,70%以上の企業が実施している項目を示したものである。すなわちほとんどの会社で,ゲッ歯類単回投与後については代謝物の検索と全身オートラジオグラフィを含めた広範なADME試験を終了してからPhase Iに入ることを示している。ICHではこれはまったく受け入れられず,厚生省とともに製薬協も今後のPhase Iのあり方を含めて欧米の考え方を受け入れることとし,基本的に表7に示すEU案に同意することとした。すなわち,ヒト臨床試験に入る前にはtoxicokinetics試験で曝露データを安全性の見地からevaluateしておくこととされ,動物のADMEに関するそれ以上のデータは,ヒトと動物の代謝を比較する段階,すなわち第二,三stepsのc1inical pharmacologyの終了時点までに用意すればよいことに決まった。これらを含めた非臨床試験の実施タイミング(M-3)に関するガイダンスは平成9年7月のICH-4でStep-4の最終合意に達し,わが国では平成10年11月に厚生省から公布された。
これに伴って従来何の疑いもなく使われて来たPhase I, II, IIIという表現も見直され,それぞれその内容と目的によりHuman Pharma-cology, Therapeutic Exploratory, Therapeutic Confirmatory Worksと呼称されることになった。このことはPhaseI,II,IIIが必ずしもstep-wiseに行われるものではなく,たとえば,従来のPhase I試験も目的に応じて臨床試験の全期間にわたって合理的に実施されることになる。同様にまた動物試験も一律にではなく,その時点での目的に応じた試験を行えばよいことになる。次に述べるわが国の新しい非臨床ガイドラインにも実施時期についてはこのM-3ガイダンスを参照することが明記されている。

拡大 |
表6 第一相試験に先立って得ておくべきADME情報(回答84社の70%以上が必要と考えているもの) |

拡大 |
表7 臨床試験に関連した非臨床試験の実施タイミング(ICH guide line, July 1997) |
5.非臨床薬物動態試験ガイドラインの改定
さてこのような国際的状況の下でわが国の薬物動態試験ガイドラインも当然改定する必要がある。平成8年7月にこのための研究班が設けられ(動態試験のリーダー:大野泰雄先生),学会,企業を含めた議論を続けた結果,大幅な改定を経て非臨床薬物動態試験ガイドラインとして平成10年6月に厚生省から発布された。表8は見直しの基本理念をまとめたものである。第1のICHとの整合性は当然であり,第2の科学技術の進歩は定量的オートラジオグラフィを念頭に置いたものである。第6のヒト組織(microsomeなど)の利用に関してはこれを非臨床試験として本ガイドラインに含めることとし,薬物相互作用の検討も含めて,ヒト代謝に関与する薬物代謝酵素を明らかにする,などの項目が追加された。なおわが国では臨床薬理学の発展が欧米に比較して遅れていることも過剰な動物実験が強いられてきた要因であり,第4に挙げられたヒト試験の重視については,先ずヒトで行うべき試験,たとえば食餌の影響,などは動物では要求しないこととし,ヒト試験ガイドライン設定については,平成10年から新たな研究班がスタートした。

拡大 |
表8 薬物動態ガイドライン(非臨床)見直しの基本理念(厚生省,ハーモナイゼーション推進研究班)(1996年12月) |
新ガイドラインの精神を汲み取るためにその前文を表9に示し,また分布の項を旧ガイドライン(表2)と比較するために表10に示した。まず,実施の別項目となっていた"全身オートラジオグラフィ"がこれは組織分布を調べる一手法であるとの趣旨から削除され,また"反復投与"が削除されて,原則として単回投与"となり,反復投与の考慮はICHガイダンスに委ねられた。われわれにとって重要なのは注6であり,全身オートラジオグラフィの有用性と定量的オートラジオグラフィの活用の両面が記載された。要約すれば組織分布試験法の今後の方向として,定量的オートラジオグラフィか組織計数法のいずれかでよく,望ましくはAR法で実施する方向を示すものと解釈される。

拡大 |
表9 非臨床薬物動態試験ガイドライン(平成10年6月,厚生省医薬審496号)前文 |

拡大 |
表10 非臨床薬物動態試験ガイドライン(平成10年6月)検討項目-2 分布 |
おわりに
以上,時代の流れとともに動物試験の意義も随分変わってきていることと,新薬開発の一層の効率化が求められてきており,定量的オートラジオグラフィとそれを支えるradio-luminography技術もその一環として,研究開発の中でflexibleな活用を考えるべきことがおわかりいただけたかと思う。ガイドラインの中に定量的オートラジオグラフィの活用につきこのように明記されたことは画期的なことで'あり,わが国はこの分野の世界のリーダーとしてその基礎研究と実用化に進むべき責務を持っていると考える。
文献
1) 中島栄一,進藤英世,栗原紀夫:Radioisotopes, 19, 532-538 (1970)
2) Shindo,H., Miyakoshi,N. and Takahashi,I.:Chem. Pharm. Bull., 19. 2490-2500 (1971)
3) Shindo, H., Miyakoshi, N. and Nakajima, E.:ibid., 20, 966-973 (1972)
4) Miyakoshi, N., Tanaka, M. and Shindo, H.:Jpn. J. Pharmacol., 30, 795-805 (1980)
5) 溝尻顕爾,乗鞍良:薬物動態, 11, 147-159(1996); Mizojiri, K., Shindo, H. and Ohno,Y.: J. Toxicol. Sci., 21, 523-527 (1996)
6) Shindo, H.: Proceedings of The Second International Conference on Harmonization,Orlando 1993, (D'Arcy, P.F. and Harron, D.W.G. eds.) pp. 332-335, The Queen's University of Be1fast (1994)
7) Shindo, H.: Drug Inoformation J., 28, 173-183(1994)
8) RLG研究会バリデーション検討分科会最終報告,薬物動態, 9, 351-416 (1994)
|

