2.ラジオルミノグラフィによる放射能測定の一般的技術に関して†
中島栄一,河合賢司
三共(株)分析代謝研究所
140-8710東京都品川区広町1-2-58
Instruments for Radiation Measurement in Biosciences. Series 3.
Radioluminography. 2. Standard Methods for Quantitative Radioluminography.
Key Words : radioluminography, Imaging Plate,bioimaging analyzar, phosphor imaging plate, autoradiography,quantitative autoradiography
Eiichi Nakajima and Kenji Kawai : Analytical and Metabolic Research Laboratories,Sankyo Co. Ltd., 1-2-58,Hiromachi Shinagawa-ku,Tokyo 140-8710,Japan
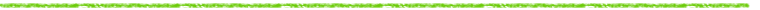
はじめに
前号で報告されたように,全国のRLG関連研究者を対象に行ったアンケート結果では,RLGの長所を生かした新しい方向性への萌芽がみられ,それとともに,これから本法を試みるに当たって注意すべき点へのさまざまな質問が寄せられている。筆者らが薬物の体内分布の測定にバイオイメージングアナライザ (BA-100) によるラジオルミノグラフィ(RLG) 法の導入を試み,液体シンチレーション計数 (LSC) 法および従来のX線フィルムによる全身オートラジオグラフィ(WBA) の定量解析法で求めた組織内濃度と比較した結果を1988年の薬物動態誌に報告してから早くも10年が経過した。その間に装置の機能は著しく改善され,装置および方法の信頼性を多施設間で検証する共同研究が相次いで実施された結果,新たな放射線測定技術として薬物動態ガイドラインヘの導入が実現されている。
本章ではこれまでに報告された多くの研究成果を振り返りながら,同一研究機関内で行われる標準的なプロトコールについて概観し,各ステップに含まれる主な変動要因について考察する。動物群の間での差,装置間の性能の違い,人的要因の寄与など,研究機関相互の変動要因ついては触れず,今後の課題として先に送ることのできるものについては項目をあげるにとどめる。
1. X線フィルムARG法,LSC法からRLG法へ
いうまでもなくWBAは薬物の体内分布に関してきわめて解像度の高い情報を与えることから,特に臓器摘出法では測定困難な微小組織や不均一組織,あるいは妊娠動物における胎児や病態動物など特殊な状況下での詳細な分布状態が明確に観察できるので定量化の意義は大きく,さまざまな取組みがなされてきた。特に脳のように複雑に分化した組織は従来の組織摘出法では解析がほとんど不可能であり,この領域ではオートラジオグラフィ(ARG) の黒化度を組織中放射能濃度に変換する手法が早くから確立され,たとえばNIHのSokoloff,Goocheeらが開発した高性能のデンシトメータ (DM) をコンピュータで制御する画像解析システムは,脳周所グルコース代謝率や受容体分布などの定量法の中心的部分として広く活用されている。富士写真フィルム社が二次元放射能分布の汎用型測定装置としてBA-100を初めて発表した当時は,DMやビデオカメラ式画像解析装置の進歩でWBAの定量化への要求が高まっていた時期であった。しかしながら,WBAは組織の種類がまちまちであり,アイソトープの濃度もバックグラウンド (BG) レベルから高濃度までの広範囲を対象とするのでX線フィルムでは限界があり,実用化にはこの問題を克服する工夫が必要であった。当研究所でも上記のSoklloffのコンセプトに基づくドラムスキャン型DMシステムを導入し,表1にあげたような試行錯誤を繰り返しつつ,WBAの定量法を1986年に立ち上げることができた。
その後,富士写真フィルム社ではBA-100の試作機が完成し,宮ノ台開発センターの好意で使用する機会を得て,14C標識FO-1561(sadenosylmethioninesulfate tosylate,SAMe)のラット組織内濃度をRLG法およびX線フイルムDM法による定量解析,そして別に行ったLSCによる摘出実験 (n = 3) の3手法間で比較した結果,上記のX線フィルム法に伴う変動要因がほとんどすべて解決されているのを目の当たりにして,RLG法への方向転換を迫られることになったのは、DMシステムの導入からわずか1年半金のことであった。
この際の3手法間の比較では,血液,筋肉,顎下腺など多くの組織はどの時点においてもRLGの定量値は大部分がLSC法における1群3例のばらつきの範囲内に納まっており,従来法との相関性が確認された一方で,肺では投与後の比較的早い時点でRLG法の定量結果がLSC法に比べて低い傾向が見られた。これは当然のことながら,WBA法は通常放血しないで分布を観察するので血液を含んだ状態の組織中濃度を与えるのに対して,LSC法は放血後の分布を測定するという両手法の特色が結果に反映したものとなっており,方法の違いに即した結果の解釈が必要なことを示している。
さらに,WBAの画像では特に腎臓では髄質に高濃度の局在が観察されており,この部位はX線フィルムではほとんどの時点で飽和して測定できず,また臓器摘出法では腎全体の平均的な濃度が得られたのみであるのに比べ,RLG法ではすべての時点で髄質に見られる高濃度の部位と皮質が区別して測定できた (第3回薬物代謝研究法の進歩講演会 "定量的全身オートラジオグラフィ'',第一化学主催,1987および薬物動態,Vo1.3,p.747.1988)。このように,RLG法は基本的な部分で従来法と一致した結果を与えるとともに,手法の特徴を生かした新しい組織内分布の解釈の道が開かれたことを示している。
|

拡大
|
表1 X線フィルムWBAの定量における変動要因と対応策 |
2 . RLG法のvalidation test
BA-100が発売されて間もなく,BA-100の解析端末を16台装備したオートラジオグラフィ研修コースが日本原子力研究所東京研修センター (連絡先 : 伊藤03-3942-4221) で行われており,当時すでにRLGの解析操作について測定者間再現性のvalidationがなされていたことは特筆に価する。そこでは研修生16人が,WBA画像上に思い思いにROI (Region of Interest) を設定して各組織の発光強度値 (PSL/mm2) を読み取り,それをスタンダードで作図した検量線で組織中濃度に変換しており,その値を16人の間で比較した結果,相互によく一致していることが明らかになった。さらに,ラジオTLCの結果も,同様に高い相関性を示すことが確認されている。この成果は未発表ではあるが,RLG法に対して確かな手応えをつかむ機会を早くから提供していた点で,本手法の普及を支える一翼を担っていたといえよう。
一方,本法の確かさを検証するための大規模な共同研究がユーザー間で相次いで行われており,たとえば「RLGはどこまで代謝動態研究に役立つか」(日本薬物動態学会主催)のテーマで製薬企業20数社が参加したWBAの定量およびTLCスポットのラジオアッセイに関するva1idation試験が行われ,その成果は1993年の同学会 (千葉) でフォーラムとして特集された (薬物動態誌フォーラム'93特集号,1994)。これに続いて,ヨーロッパでも数社の製薬機関が共同で同様の試験を実施している。
その後,技術の普及と情報交換の場としてRLG研究会 (事務局 : 五月女 03-3406-2201) が1991年3月に設立され,同研究会の主催で実施された製薬企業30数社の共同による"装置の面均一性,直線性に関する施設間再現性試験"の成果が,第14回の同研究会 (1998),同年9月の薬物動態談話会 (東京) および同年ISSX (5th Int'l Meeting of Int'l Society for the Study of Xenobiotics,ケアンズ) で報告された。これらは別の章で詳細に報告される予定である。
3. 薬物分布ガイドラインの現状
薬物分布研究は,被検薬物の体内挙動の経時変化と蓄積性あるいは残留性を知るために,単回投与および反復投与して臓器内および組織内濃度を測定することでる。医薬品開発過程では前臨床試験の一部として薬効,毒性発現の組織選択性,種差,性差などを考察し,ヒトにおける有効性と安全性を予測する一助とされる。新医薬品について吸収,分布,排泄に関するデータが要求されるようになったのは1967年からである。特にWBAの普及によって分布の全体像,および小さな臓器,組織への分布や臓器内の局在性を明らかにしたデータが増加するようになった結果,1975年にはARGの写真から分布傾向について十分な説明を行った資料が要求されることとなった。これは1987年のガイドラインにそのまま受け継がれたが,欧米ではヒト試験を重視するのに対し日本では動物偏重傾向があるなど,試験内容について国際的整合性を図る要求が生れ,ICH会議が1989年にスタートした。そこではLSC法とWBAによる分布実験の重複が話題となり,改善策としてRLGの利点を活かした定量的ARGの導入が提案された (1993年,進藤ら)。
さらにICH会議の合意を受けて,日本の薬物動態ガイドラインを改定するための研究班(大野リーダー) が1996年に設けられ,欧米の意見を取り入れた新ガイドラインが1998年6月に提示された。その「臓器内及び組織内濃度」の項には,"全身オートラジオグラフィは被検物質の全身的分布を定性的に把握するのに有用である。定量的オートラジオグラフィ等,新しい技法も適切にバリデートされたものであるならば,臓器及び組織内濃度を測定する方法として利用してよい"という注釈が明記されている。
このように,世界に先駆けてガイドラインにWBAの定量解析法が明記されたことは画期的なことであり,その特色を活かした全身レベルでの薬物固有の局所分布特性を掴み量的に把握する手法として応用性は広い。
薬物動態研究におけるRLG法の応用領域として,組織中濃度の測定のほか,TLCによる分離放射能スポットの測定および血液などLSC法ではカラークエンチングの影響で測定が困難なサンプルの濃度の測定が行われており,それらに関して以下に記述する。
4. RLG法による組織中濃度の測定
放射性同位元素 (RI) 試料を薄切して平面状とし,RLG法でRI濃度を求める例として,WBAの定量法の基本的な流れと留意点を図1に略記した。
|

拡大
|
図1 RLG法によるWBAの定量法と留意点の概要 |
ある一定のプロトコールのもとで得られる試料の発光強度 (PSL/mm2) は,試料中に含まれる濃度 (Bq/g) と比例関係にあることは多くの事例ですでに明らかであるが,面検出器として定量の精度を保つにはイメージングプレート (IP) の保守管理が必要であり,定期的な感度の均一性や汚染の有無を確認することが推奨される。そのための面線源としては14C.sheet (Raytest社製14C-STD,BAS-2000用,問合せ先 : エムエス機器,03-3235-0661,06-396-0505) あるいは147Pm-sheet (根本特殊化学 ㈱,0297-24-1045) がどちらも20×40cmのものを提供している。自分で作成する場合は適当な濃度のRI溶液にX線フィルムを浸して乾燥した線源がSTDとして使用でき,安価で実用的である(問合せ先 : 原子力研究所,柴部ら03-3944-4565,第9回RLG研究会,第32回 理工学同位元素発表会)。
IPへの露出は,十分に乾燥した試料を厚紙などに張ってから表面をルミラー膜などの薄膜でおおってIPを保護する。薄膜の厚さは5μm程度が扱いやすく,14Cβ線の減弱も10%程度でそれほど問題にならない。
3Hは専用のIPに直接に密着して使い捨てにするのが一般的だが,Floating-RLG法 (慈恵会医科大学,吉沢ら,第10回RLG研究会) や,O.5μm程度のフィルムで遮蔽し,露出時間を長くとる方法がIPを再使用できる手法として紹介されている (東京大学RI総合センター,野川ら,第15回RLG研究会)。露出時間は放射能濃度に応じて数時間から3日間程度行う。どの程度露出したら良いのかが予測できない場合には,とりあえず数時間の試し露出を行って最適露出条件を割り出すほうが確実である。X線フィルム法では,通常の条件 (14C投与量 : 3.7MBq/kg前後,切片厚 : 50μm,フィルム : Kodack SB-5) では約20日程度の露出期間が必要であったが,IPでは数時間の露出で荒い像ながら定量性のあるRLGを得ることができる。さらに露出時間を延長することによって色調は強調され,緻密で鮮明な画像が得られ,over nightが翌朝から解析できるので都合がよい。24時間以上の露出を行う場合には,宇宙線の影響を低減するために,たとえば鉛5cm厚のシールドボックス内に置くことが望ましい。
RLGによる定量WBA手法のポイントとしては,次の3点が挙げられる。
(1) 厚さの均一な全身の切片を再現性よく作成すること。
(2) 目的組織での測定部位 ROI) の正確な位置決め。
(3) 読取り値から組織内濃度値への正確な変換。
4・1 厚さの均一な全身切片を再現性よく作成する
現在では高性能の自動化されたクライオミクロトーム,および超硬質ミクロトームナイフの出現によって,それほどの熟練を要さずに均一な切片を再現性よく得ることができるようになった。しかし研究機関によっては,切片作成のトレーニングを6か月間実施したうえで本番の試料を処理するところもあり,厚さの均一性を定期的にチェックすることが望ましい。
切片厚が各部位で均一に切れているかをチェックするには,4,5枚の連切片を取り同一組織で読取値の変動を見る方法がある。また,動物と平行に置いて包埋凍結した厚さマーカーを切片と同時に薄切し,マーカーの各部位の発光強度を測定することによって,切片内および切片間の厚さの再現性を判定することができる。厚さマーカーの例として,筆者らは3.7KBq/m1程度の14Cを含む血液を透析チューブに詰めて凍結し,これを動物と平行に置いて,CMCペ一スト中に凍結包埋する方法を用いている。他に切片厚をチェックする方法として,クリオスタット内にレーザーフォーカス変位計を設置し,切片を薄切する前後のブロック表面の変位を測る方法が試みられている(富士写真フィルム,森ら,ISSX,1995,生体科学,羽鳥ら,薬物動態学会,1997)。
本測定法の作業能率を改善するには,試料(切片)作成の効率を高めることが効果的であり,そのための一法として,凍結,包埋時の姿勢を一定に保ち,できるだけ多くの組織が同一断面に現れるようにすることが有効である。それによって測定部位の位置決めが正確に行えるとともに,無駄な切片の採取を減らして必要最小限の切片を採取することで,乾燥スペースの節約,処理能力の向上が図れる。その対策として,動物凍結用ホルダーの使用,包埋動物数の制限(1フロック1-2匹程度),荒削りと精密切片採取のミクロトームを別にし,並列の作業とする,乾燥時間を短縮するために切片厚をできるだけ薄くする(しかし露出時間は長くなる),また切片乾燥のための専用フリーザーを設置するなどの方法があげられる。
また,動物の前処理として除毛,必要ならば抜歯を行い,試料の硬度,サイズがミクロトームあるいはナイフの能力を超えないようなプロトコールを組む。たとえば体重が極端に大きいとか,老齢ラットで骨や牙が著しく硬い場合などは一定の厚さで切るのは熟練がいる。
ときにナイフの研磨角度が問題になり,各自が専用のナイフを持ち,自分で研磨しているところもある。よい切片の作成は最も大きなポイントの一つであり,今後の課題として,メーカーと使用者とが協力してより優れたミクロトームおよび強固なナイフを開発する努力が望まれる。
4・2 目的部位の濃度値の正確な読取り
IPの全面(あるいは目的部位)を走査することで解決しており,位置解像度を高めるために25-100μmという微細な光径で走査し,拡大観察に堪える像を得ている。目的部位の濃度値を読み取る際の配慮として,下記の点があげられる。
(1) 切片のひび割れ : 適正な厚さ,切れるナイフ,適当な周令,適度な乾燥状態
(2) 微小組織分布,不均一分布の扱い : たとえば拡大観察し,できるだけ他の組織の混入部位を避けて小さなROIを数多く囲むか,大きめのROIを指定して平均値を用いるか,その範囲の発光強度をヒストグラムで解析し,濃度範囲を指定して平均値をとるなど,それぞれの機関で一定の基準を設けて解析する。
(3) 消化管内容物など高濃度分布部位のフレアによる周辺組織へのかぶり : その部分のみをテープ,鉛箔などでマスクして,フレアの影響を除去する,読取の方向を変える。
4・3 読取値から組織内濃度値への変換
一定の厚さの切片では,発光強度と試料中濃度は直線関係になるので,この直線でプラスチック比較線源を試料中濃度に換算し,STDとして使用する。多くの組織は一定の(CV)内でこの直線が検量線として使用できるが,肺や脂肪組織の分布を正確に求める場合は,それらの組織でカーブを求めて,上記STDをそれぞれの濃度に換算しておく。たとえばReivich,Sokoloffら(1988)は,3-O-methyl-g1ucoseが脳内に均一に分布する性質を利用して脳を2分し,それぞれをLSC法とRLG法で解析して検量線を得ており,長塚らは脳以外の組織にもこの方法を用いてWBAの定量を行っている。
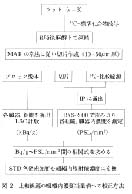
筆者らは次の方法で検量線を作成した(図2)。
(1) ラットに14C-2-deoxyglucose (n=3) を投与(複数濃度必要)。
(2) 15‐30分後に凍結して,3種の厚み (20,30,50μm) の標準全身切片を作し,IPに7,24および72時間露出してRLG法 (BAS-2000) で肝臓,筋肉,血液,心臓,肺,脳などの発光強度 (PSL/mm2) を測定する。
(3) 切片作成後の凍結残体から,(2) の測定部位に当たる組織を凍結状態で摘出し,組織溶解後にLSC法で組織中14C濃度 (Bq/g-organ) を測定する。
(4) 両測定値をプロットして相関式を得る。この相関式は切片の厚さごとに変化するので,3種の厚さの切片をIPに露出してそれぞれの場合の相関式 (r >0.99) を求める (表2)。
(5) 上記検量線作成に用いた標準組織切片は生体物質なので長期保存ができない。そこで市販のプラスチック比較線源を入手し,それらを未知試料として標準組織切片と同時に露出して,発光強度を上記の相関式で放射能濃度当量'値 (Bq/g-wet organ) に置き換える。これを校正済みSTDとして多数用意し,実際の測定時に試料とともに露出する。
露出ごとにSTDを置いて検量線を作成して未知試料の濃度値を求めることが望ましいが,一連の実験ではいずれのIPでもほぼ等しい検量線が得られる場合が多く,必ずしもすべてのIPにSTDをおく必要はない。
同一の標準線源について露出時間を変えて (たとえば2,4,7,16,24,72時間など)数本の検量線を作成し,試料の露出時間に合わせて検量線を選ぶ方法もとられる。この場合,IPをカセットから取り出してから読み取るまでの時間をそろえ,また室温が大きく変動しないなど,一連の実験条件が変動しないようにする。
STD (比較線源) として入手可能なものを次に示す。
(1) 自製
1. 14C-polymethyl methacrylateを非放射性同種樹脂で希釈したsheet (Longshaw,S. and Fowler,J.S.L. : Xenobiotica,8,289-295 (1978)
2. 各種14C標準溶液をX線フィルムに染み込ませて乾燥したもの。(原研 柴部ら,前述)
(2) 市販品
1. Amersham : 14C-polymethyl methacrylate (特注品) 20×20mm,厚み1mm,14C濃度8段階 (0.235 - 23.7kBq/g-compound) これを5mm角に切り分けたものが使いやすい。
2. American Radiolabeled Chemicals Inc. (室町化学㈱) : ARC-146 2.5×7.5cmのスライドグラス上に16切片を貼付,14C濃度16段階 (0.074-1 295kBq/g-plasticなど)
3Hの線源はスライドグラスに貼付したものは40KによりBGが上昇するので,樹脂プレートに貼付したものを求めるとよい。
また1.,2.ともに同一の濃度表示のものでも実際の濃度は異なるものがあり,個々について組織内濃度への校正を行うことが望ましい。
|
拡大
|
図2 比較線源の組織内濃度当量値への校正方法 |
|

拡大
|
表2 組織内濃度と発光強度間の相関関係 |
5. 定量的ARGの応用
5・1 吸着RLGによる受容体分布の観察
試料が小さく拡大して観察するので解像度の高い装置が望まれ,現在は解像度25μmのBAS-5000が開発されており,将来はより微小化へと向かうことが予想される。したがって核種はβ線の飛程の短い3Hが望ましい。
一方,3H用IPには保護膜がなく,試料との接触によって汚染する恐れがある。この点は比放射能の高い125I標識リガンドを用いるか,あるいは受容体RNAと35S標識プローブを切片上で反応させるハイブリダイゼーションARGの手法を用いれば,保護膜のある通常のIPで受容体分布の解析ができる。
受容体分布の解析は,total bindingの画像から隣接切片で作成した非特異的吸着像を差し引いて得た画像(特異的な結合を示す)を用いることが多い。
5・2 二重標識WBAの解析
半減期の差を利用する方法,たとえば18F (半減期109.8min) と14C (5 730y) がしばしば用いられ,18Fなどポジトロン標識体の供給が確保されればきわめて優れた方法である。一般には飛程の差を用いて,まず遮蔽を置かずにトータルの放射能を測定し,次にルミラー膜などの遮蔽を置いて一方の核種のみを検出する方法が用いられており,たとえば3Hと14Cなどの組合せが多く見られる。筆者らの条件では3Hと14Cの感度比は約1 : 270であり,適当な色調の二重標識画像を得るには,3Hを14Cの約300倍多く投与する必要があるが,一般に3H標識体の比放射能は14Cよりも高いので,上記の量比を投与することは不可能とは思われない。しかしなお,3H-IPの感度の上昇や,共存する2核種を分離定量するソフト面での改善など,今後の対応が期待される。
6. 平面試料中RI量の測定法
6・1 TLCラジオスポットのRLG法による測定
TLCや電気泳動で分離された放射性スポットの測定におけるRLG法は,以下に示すように従来のX線フィルム‐LSC法に比べて多くのメリットをもつことから,ルーチンの手法として早くから使用されていた。従来法ではX線フィルムに露出,現像してスポットの位置を確かめ,各スポットのシリカゲルをバイアル瓶中に掻き取ってLSC計数するという方法が一般的であり,低レベルのスポットを検出するために数週間の露出が必要となり,ラベル体の分解のおそれがある。そのほか,X線フィルムの現像・定着条件を一定に保つ必要がある,X線フィルム上のスポットのパターンをプレート上に正確に転写することがむずかしいこと,特に,隣接したスポットを正確に分離して掻き取ることは困難であること,そして多くの放射性スポットのシリカゲル末を掻き取る操作にはシリカゲル粉末の散逸による汚染の危険があり誤差の原因となる,などが変動要因としてあげられている。一方,RLG法ではTLCプレート上の放射能分布をIPで直接に読み取るのでフィルム現像,掻き取り操作などの変動要因が省け,シリカゲル粉末による人体や周辺の汚染のおそれがない,またプレートは損なわれないので再露出あるいはプレートからの代謝物の抽出,分析などの処理ができる,などの特徴があげられる。
TLCラジオスポット測定法の施設間再現性はフォーラム93で確認されており,詳細は別章に譲る。
6・2 ポリエチレン濾紙スポット法による血液中放射能の定量
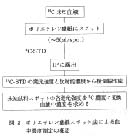
血液中14C濃度の測定など,放射性核種を含む溶液は,サンプルオキシダイザで燃焼するか,可溶化剤処理後に脱色してLSCで計数するのが常法であるが,血液を適当な吸収材に吸収・乾燥させ,平面状の試料とすることによって,IPに露出してRLG法で濃度を簡便,正確に測定することができる(筆者ら,三共年報,1994)。この手法は血液に限らず,血清や各種溶液,あるいは,細胞のホモジネート等,ポリエチレン濾紙上に伸展、乾燥できるものであれば応用できる,また14Cの他32P,45Ca,125Iなども良好な直線関係となり応用性は広い。特に,燃焼または脱色,溶解などLSC法に伴うカラークエンチングを除くための処置が省けるとともに,多数の試料でも同時に濾紙にスポットでき,一回の露出で全ての濃度値が得られ,測定に要する時間を短縮できる。さらに,LSC廃液やバイアルが出ないことも廃棄物減少と可燃性廃棄物への移行につながり,望ましいことである。方法の概要を図3に示した。
6・2・1 保持材の検討
保持材としては血液のように粘度の高い試料を速やかに吸収し,β線に対しての自己吸収が均一で,かつ容易に入手できるものが望ましい。
(1) TLCプレート : 水溶液には吸収性がよいが,血液はほとんど吸収せず不適当であった。また,廃棄物は非圧縮性不燃物となり厄介である。
(2) 濾紙 : 定性分析用濾紙を数種類検討したが,いずれも裏面に浸透するためにスポット量が不正確になりやすかった。一方,ポリエチレンを裏打ちした濾紙 (東洋濾紙㈱,千代田保安川晶㈱扱い) では乾燥後に濾紙が波打つ難点があったが,血液に対して吸収性がよく,スポット量と発光強度の相関性が高いなどで,検討した素材の中では使用に耐えるものであった。
6・2・2 血液のスポット
あらかじめ濾紙上にマス目を記入し,ヘパリン処理した血液を,なるべく厚くならないように均一に広げてスポットするのがよく,20-30μlであれば2.5cm角,50μl程度なら3.5cm角のスペースが必要である。
血液によるβ線の自己吸収の影響を見るために,3cm角当たり10から50μlをスポットした場合の発光強度は直線となり,この量の範囲ではスポットの差はほとんど無視できることがわかったが,一連の実験ではスポット量をできるだけそろえる方が正確な結果が得られる。血液をスポット後,十分に乾燥したポリエチレン濾紙は,厚紙等の支持体に張ってから表面をルミラー膜などの保護膜でおおった後にIPに露出する。発光強度の測定は200μmの光径で十分であり,スポットよりやや大きめのROIを設定して全発光強度値を測定する。
6・2・3 方法の再現性
RI非投与ラットの血液に14C-2-deoxyglucoseを添加して数濃度段階の標準血液試料を作成し,これら標準試料の各20μlをバイアル瓶に3本ずつ採取し,LSCで濃度を測定した。
同時に各20μlをポリエチレン濾紙に3回ずつスポットしたものをRLG用標準線源として用意し,未知血液試料とともにIPに露出した。この検量線は相関係数0,999となり,高い相関性が認められた。
一方HPLC溶出液をマイクロプレートに採取して放射能を定量する方法が紹介されている (馬場ら,理工学同位元素発表会,1992)。LSC法に比べ低レベルのピークが定量できるほか,多数の試料が一度に測定でき,より簡便,正確な測定法として使用された例が示された。
|
拡大
|
図3 ポリエチレン濾紙スポット法による血中濃度測定の概要 |
7. アンケートにおける頻度の高い質問と解答 (FAQ)
Q (1) 適切な定量時の露光時間は?
A1 目的の部位が直線範囲すなわちBAS-2000ではほぼ0.4-4000PSL/mm望(感度10000)に入るように設定。
A2 通常数時間から24時間程度,16時間がovernightで使いやすい。
A3 目安であるが,PSL/mm2が1程度となる14Cの組織中濃度は,切片厚30μm,24時間露出の場合で,100Bq/9-tissueである。
A4 0.4PSL/mm2以下ではゼロと判断され,定量できない。それ以上になるよう露出時間をとる必要あり。
Q(2)定量的WBAを行う場合,定量操作に時間がかかるが,もう少し短くならないか。(本章4・!参照)
A1 条件を設定すれば自動的に結果が解析されるといった,LSC並みの自動化ソフトがユーザーサイドで活発に行われると思われ,近い将来スピードが改善されることを期待したい。
A2 数匹を同時に薄切りできれば能率的である。マウスはブロックに16匹固定でき,れ=3でも5時点分15匹が1回の薄切りですむ。マウスは胆嚢内の放射能で胆汁排泄の有無を判定できるメリットあ㌦また切片g乾燥効率の改善も効果的。
A3 RLGの特色の一つはLSC法では得られない微細組織での分布に威力が発揮される。n=:1でも時間経過で類似のパターンが確認できれば必要な情報が得られる。
Q(3) ROIの決定が客観的に必ずしも行えない。暖昧さを減らすにはどうするか。(本章4・2参照)
A1 目的に応じて方法を決めておくとよい。
全体の平均的な濃度を求める場合には臓器の広い範囲を囲み,局在性を示すには拡大して微細構造に応じたROIを設定する。PSLの範囲を指定することもできる。
Q(4)切片の厚みの再現性・均一性をいかに保証するか。(本章4・1参照)
A1 試料の硬度がミクロトームの能力以内であれば,熟練で誤差範囲の一定のものが得られる。
A2 筆者らは3.7kBq/mlの14C一血液を透析チューブに詰めて凍結し,動物と同時に薄切りして厚みのチェックをしている。これは一例であり,それぞれの機関で方法を決めてValidateすればよい。
Q(5) 検量線はどのように作成し利用するか。(本章4・3参照)
A1血液や組織でLSCとRLGの相関牲を求め,それを市販のプラスチック比較線源に移しておけばよい。直線性の日内および日間再現性,研究機関間の再現性を確認することが望ましい。
Q(6) フレア現象をどのように克服するか(特にWBA)。
A1 経口投与全身分布実験の場合に特に問題になる。あらかじめ短時間の露出で露出オーバー部位を確認し,消化管内容物等を薄い鉛ホイルなどで遮蔽する,切片のその部分を切り抜いて露光する,などの工夫がいる。
A2 読取装置を共焦点方式(BAS-5000またはBIO-RAD社製など)に変える。
Q(7)生の植物をそのまま使用するため,接触の強さによって変動が生じ,定量的なデータが得られない。
A1 試料をアイロンやプレス装置などで平面状に伸展し,水分を除いてからルミラー膜をかけ露出する。
A2 WBAと違ってPSL/mm2とBq/g-tissueの対応が難しいように思われる。できるだけ再現性の得られる条件を選んでPSL/mm2またはPSL/R0Iそのもので評価する方法もあるのでは。
A3 接触の強さの変動が測定結果の'CVにどの程度影響するか,確認して行えばよいと思う。
A4 単純な押し葉では定量的なデータは得られない。茎幹や葉などの断面で組織中濃度と発光強度間のファクターを求めておけば,動物組織と同様定量が可能。
Q(8) X線フィルムARG像と比較した場合,まだどうしても解像度が落ちる点が,そのまま論文用としてはまだまだ使用できないのではないかと思われる。論文投稿にそのまま使用でき
るくらいまで解像度があげられないだろうか(そうすれば,もっと利用範囲が広がるのではないか)。
A1 脳神経領域ではLCGU,受容体結合の脳ARGをX線フィルムおよびRLGともに50μmの解像度で読んだものが投稿に使用されている。
A2 出力装置の問題であれば別の章で詳述される予定である。最近のプリンタの状況をメーカーに間い合わせることをお勧めする。
A3 像が荒れるのは露光時間が短いのではないか。
Q(9 )RLGによるQWBAの検討を行おうと考えているが,当社には平面線源がないので平面線源を用いない方法を考えている。そのためには,組織の比重や含水率を求めなければならないので,組織の比重を具体的にどのように求めればよいだろうか。(本章4・3参照)
A1 実施例が報告されており,参考にされたい(根本特殊化学,馬場ら,0425-92-4504)
A2 質問は,切片の上から平面線源を当てて組織間の自己吸収を補正する方法⑭線ラジオグラフィ法)を念頭におかれたものと思う。'平面線源に関しては,未使用のX線フィルムやTLCプレートなどをRI溶液に浸して均一な両線源を自分で容易に作成できる(本章4参照)。少なくとも均一な面濃度が1枚の切片が照射できる大きさで得られることが望ましい。ラジオグラフィ用RIとしては,14Cの他エネルギーのやや大きい33P(E㎜:0,249,~2:25-3d),45Ca(万ma亜:0,257,~2:165d)なども使用できる。
A3 当然ながら組織の比重を求める方法以外に,同一組織で放射能濃度(LSC法,Bq/g-wettissue)とPSL/mm望(RLG法)を求め,両者の相関式で発光強度を組織中濃度に換算する方法が実際の状況に近い手法として使用されている。この方法の再現性はForum'93共同研究でも確認され,また第7回RLG研究会報告(藤沢薬品,・竹下ら,第一化学,長塚)はじめ多くの事例が提供されており,参照されたいo
Q(10) 医薬の承認申請及び農薬の登録申請資料として,どこまで六機器を利用できるか(定量的なデータを得る場合,定量性のvalida-tionをどのように行うか)。
A1 放射線測定器としてのva1idationと,WBAなど応用領域部分を分離して考えればよい。
A2 装置に関しては感度の面均一性,直線性の日間変動,IPの面均一牲,感度変化,読取方法などそれぞれでSOPを作成しておく。そのためには適当なSTDが必要であり,その入手方法,あるいは自分で作成する方法は前記の個所を参照れたい。
A3 応用部分に関してはそれぞれでSOPを定めておけばよい。
Q(11) RLGを用いた濃度測定をほとんど文献で見かけない。現在のこの測定法の置かれている位置づけがはっきりしない。医薬品開発における測定法の一つとして「市民権」をまだ得ていないのではないだろうか。
A1医薬品開発における位置づけは厚生省で正式にガイドラインに採用され,その意味では市民権は確立している。あとは市民一人一人がそれぞれでステータスをアピールしていく段階であると思う。
A2RLGの特色を活かした応用例の投稿はまだ少なく,今後が期待される。
Q(12) IPの均一性,読み取り値の再現性をどのようにして確保するか。
A1 RLG研究会のサブグループ共同研究で,両線源および1O濃度段階の標準線源を29の研究機関で回送し測定した結果が1998年4月のRLG研究会で報告された。
A2 SOPを作成する際の参考になる資料がRLG研究会のメンバーに提供されている(間合せ先:03-3406-9673,RLG研究会事務局,前述)。
Q(13) 従来から行っている,TLC上のスポットを掻き取って波シンで定量する方法から,IPに切り換えたいの'だが,結果がパラレルではない。なぜか。
A1 薬物動態学会Forum'93の多施設共同研究で同一試料を回送し各スポットの存在比をLSCとRLGで比較した結果は対応することが確認されており,基本的には代変法としての問題は解決されている。
A2 両手法の比較データの事例を参考にされたい(住友化学,水野,第7回RLG研究会など)。
A3 結果のCVがどの範囲かを確認する。
Q(14) 代謝分析において,TLCおよびHPLC/マイク0プレート分画法により得られる14C試料をBASを用いて検出する際,各バンドあるいは各画分において(特にTLCでは原点付近,HLPCではボイド画分),生体成分や溶出成分等による自己吸収の変動が起き,定量値の誤差を招くが解決法は?
A1 共存する生体成分による影響はTLCの手法の問題であろう。明確に分離されたスポットであれば両者間の相関性はきわめて高いことが上記のQ(13)一A1などで確認されている。自己吸収に影響する量の生体成分が含まれると,スポットが明確でなく分離が十分でない恐れもあり,この場合にはかきとり一LSC計数結果とRLG法のROI設定間の再現性が低下するのではないか。それぞれのケースで共存成分の影響がどれくらい測定結果のCVとしてあらわれるかを確認しておき,それが容認される範囲を越えていれば,サンプルを精製してTLCにかけるなどの配慮が必要になると思う。
8.まとめ
(1)定量ARGの変動要因のポイントはいかによい切片が切れるか,すなわち既存のWBA技術の確立にかかっている。すでに高度の技術を確立されている研究機関では,各ステップの変動要因について検討がなされており,貴重なノウハウを盛り込んだ優れたプロトコールが作成され,より正確な定量が可能であろう。また,これから定量ARGに着手する機関では,状況の類似した施設のプロトコールあるいはノウハウを導入することによって変動要因を軽減することができる。
それらノウハウのオリジナリティが評価されるような方法が配慮されれば,積極的な情報交換の場をもつことができる。さらに,よい切片を作成するためにはよい装置が必要であり,ミクロトームメーカーによる装置の改善,情報の提供などがより一層おこなわれることが顕われる。
(2)LSC法がシンチレータの焼却やバイアル瓶の洗浄などやっかいな後処理をしなければならないのにもかかわらず人気が落ちない理由の一つは,「サンプルを入れておけば翌日には結果が出ているから」ということであった。しかし数十年前のLSCはEXR方式ではなくサンプルごとに内部標準を加えて測定効率を補正しなければならず,また核種に合わせてゲインやウィンドウ幅を調整した時代を経て今の自動化システムが生まれたのであって,RLG法も今後自動化の時代を迎えるであろう。特にハイスループットロボットからでる液体試料などROIを一定に設定できるものは実現が早いと思われ孔メーカーによる基本的な部分の自動化に加えてユーザーによる応用面のシステム化,ネットワーク化が今後活発に討議されることを望みたい。
(3)一方,本手法は開発されてから10年を経たとはいえ,今後改善が望まれる点は少なくない。主なものとしては,スキャナの構造に起因 するフレア現象であり,高濃度部位の周辺にカブリが生じる点の解決が望まれてきた。この点は共焦点方式のBAS3000,BAS5000およびBIO-RAD社の装置では解決されており,またユーザー全体から見てフレアが出るほどの高濃度を扱うケースは主にWBAの定量くらいで,それほど多くはないであろう。しかし,WBAで常用する20×40cmのIPが読める機種は不思議なことにいずれも集光ガイド方式であり,今後のメーカーの対応が望まれる点である。また試料の形態が画面上で観察できない点の対策として,スキャナ入力との組合せで試料画像とRLG画像を同じ画面に描出し,切片画像上で組織をトレースすればRLG上でROIが設定されてPSL/mm2が得られるようなソフトの早期実現が待たれる。またシステムが高価であった点は改善されつつあるが,保守・点検の一層のサービス改善,ユーザーサイドでできるチェック体制の提供など期待は大きい。
(4)たとえばキラルカラ午の出現でラセ1体が分割して観察できるようにな筑・葵こがら光学異性体の代謝研究に新しい見方が生まれたように,RLGによるWBAの定量という新たな手法の出現によって,薬物の体内分布研究領域で「検出の解像度」,「検出の精度」が改善され,それによって従来の平均的な放射能濃度では判断できなかったものが見え,新しい解釈ができるようになる。たとえば,LSC法で肝臓に高濃度に分布した薬物が分布の少ない薬物に比べて毒性が低いようなときに,RLG法では胆汁排泄を示すスポット状の分布が明瞭に観察されるなど,分布と薬効,毒性との関連づけを含む新しい解析が出来る段階を迎えたといえよう。
|

