8. マイクロプレートラジオルミノグラフィとそのラジオ
高速液体クロマトグラフィへの応用
堀江正信
東京薬科大学
192-0392 東京都八王子市堀之内 1432-1
Key Words :
measurement of radioactivity, radioluminography, microplate, HPLC eluate, radio-HPLC
Instruments for Radiation Measurement in Biosciences (Series 3: Radioluminography), 8. Microplate-radioluminography and Its Appli-cation to Radio High Performance Liquid Chromatography. Masanobu HORIE: Tokyo University of Pharmacy and Life Science, 1432-1, Horinouchi, Hachioji-shi, Tokyo 192-0392, Japan.
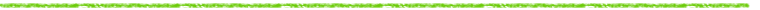
はじめに
生体成分や薬物代謝物の分析において盛んに利用されている高速液体クロマトグラフィ (HPLC) は放射性同位体トレーサ実験においても利用されている。 しかし, HPLC カラム溶離液中の放射能の測定法として確立された方法は存在せず, 目的に応じていくつかの方法が使い分けられている。 一方, 放射能の二次元検出法として開発されたラジオルミノグラフィ (RLG)1) は感度と定量性が優れていることから, X線フィルムに代わる方法として全身オートラジオグラフィの分野を始めとして, 電気泳動ゲルや TLC プレート上の放射能分布などの測定に用いられ, その利用方法が盛んに研究され, 本シリーズにおいて多くの応用例が紹介されている。
ここでは, 最初にマイクロプレートを用いた RLG について, 次いでマイクロプレート-RLG を HPLC 溶離液中のβ放射体 (主として 14C) の測定に応用する方法について紹介する。
1. マイクロプレート-RLG
β線放出核種の測定には検出効率が高いこと, 自己吸収が起こらないことなどの理由から一般に液体シンチレーション計数装置 (液シン) が使用されている。 しかし, この方法では試料が回収できない, 多量の液シン廃液が排出されるといった問題点が存在する。 後者の問題点を改良するためにプラスチック製の小さな容器の底部に固体シンチレータを固着させた製品 (商品名: ReadyCap, LumaCap) などを用いる方法2)なども開発されている。
一方, RLG は二次元放射能分布測定法として専ら用いられていた。 少量の液体試料をマイクロプレートの各ウェルに取り, 乾燥後イ
|
拡大
|
表 1 マイクロプレート-RLG と液シンによる測定の再現性の比較 |
メージングプレート (IP) と露光し, 露光した IP にレーザー光を照射し発生した光輝尽性発光 (photo stimulated luminesence: PSL) をイメージングアナライザ (BAS) で解析することにより, 同時に多数の試料の測定が可能となることから, マイクロプレート-RLG が開発された3)。
生物実験で一般に使用されている 48 穴のマイクロプレートのウェルの深さは 10 ないし 18mm であり, これらの深さのプレートを測定容器として用いると幾何学的効率が低下し, 試料と IP の間に存在する空気層によりβ線の多大な吸収が起きてしまう。 現在ではウェルの深さ 5mm, 半径 5.6mm のマイクロプレート (130×80mm) がマイクロプレート-RLG 用に製造, 供給されている(RLG-プレート研究会 (042-591-8677) より製造,供給。)。 このマイクロプレートは液量が 300μl までの試料に対応できる。 また, 200×400mm のワイド IP を用いることにより, 1 枚の IP で一度に最大 6 枚のマイクロプレートが, すなわ 288 個の試料が同じ条件で露光できる。
1.1. マイクロプレート-RLG における検出効率
RLG において測定試料をある一定時間 IP に露光した後, ただちに解析して得られる光輝尽性発光値 (PSLOB) はバックグラウンドの PSL 値を PSLBG, マイクロプレートのウェル内に存在する放射能を A(Bq) とすると次式で関係づけられる。
PSLOB=kAf+PSLBG
k は 1Bq の放射性同位体からこの一定時間内に放射された全放射線のエネルギーが IP に吸収されたと仮定したときの PSL 値, f は検出効率である。 ここでは要点だけを述べるにとどめ, それぞれの定義の詳細については馬場氏の論文4)を参照されたい。 検出効率に影響を及ぼす因子としては幾何学的効率, 測定試料と IP の感光層との間に存在する物質による吸収, 自己吸収などが考えられる。
ウェルの半径, 深さが等しく, 試料と IP との距離が一定であれば幾何学的効率を同一にすることができる。 したがって, マイクロプレート上に IP を置いて露光する場合には, IP に機械的損傷を与えない程度の重さを有する平面板を置くなどして, 試料と IP 表面間の距離をすべての試料について同一にする必要がある。
ウェル内の測定試料から IP の感光層の間に存在する物質による吸収も当然検出効率に影響を及ぼす。 ウェル内の測定試料から IP の感光層までの間には空気層, また IP の放射能汚染を防止するために置くルミラー膜および IP の保護膜が存在する。 この吸収による分だけ IP の感光層に到達するβ粒子の数は少なくなっているはずであるが, すべての測定試料が同じ割合の吸収を受けることになるので, これはあまり大きな誤差の要因にはならない。
軟β放射体である 14C から放出されるβ線は自己吸収を強く受ける。 自己吸収が特に問題になるのは, 不揮発性の塩類などを含む溶離液を用いた HPLC 溶離液のフラクション, 血清, 尿, 臓器ホモジネートなどの場合である。 塩類を含む溶離液を用いてグラジエント分析をした場合には, 塩濃度の変化に伴い, 自己吸収の割合も変化するので, 定量実験の場合には特に注意する必要がある。 いずれの場合も, 標準試料に自己吸収を起こす物質を添加し, 補正することが望まれる。
また, 測定試料は十分に乾燥しておく必要がある。 たとえば 1μl(=1mg) の水分が残留していても, 自己吸収によって PSLOB が 20% 以上も低下してしまうので, 測定試料は乾燥終了後少なくとも 1 晩, デシケータ中で乾燥する必要がある。
検出効率に影響を及ぼす他の因子としてはβ線の後方散乱, フェーディングおよび散乱光によるクエンチングなどが挙げられる。
14C から放射されたβ線がマイクロプレートの材質によって後方散乱され, それだけ PSL 値は高くなっているはずであるが, 後方散乱される確率は小さく, またすべての測定試料が同じ割合で後方散乱を受けることになるので後方散乱は大きな誤差の要因にはならない。
IP に蓄積されたエネルギーはフェーディングによって失われて行く。 フェーディング速度と露光温度の関係はアレニウスの式に従うものと考えられる。 フェーディングは IP 全面にわたって均一に起こっているので定量分析では特に大きな問題にならないと考えられるが, 露光終了直後に解析を行うことが望ましい。
IP に蓄積されたエネルギーが散乱光によって失われ, 結果として PSLOB が小さくなる現象 (一種のクエンチング) にも注意する必要がある。 散乱光によるクエンチングを防ぐには, 露光から解析に至る期間を通して, 露光容器全体を暗幕で覆うことなどにより散乱光がIP に当たらないように注意すべきである。
PSL 画像は 1 回の消去操作では完全に消去されるとは限らないので, 慎重を期する実験では消去操作後, IP と試料を露光する前に, その IP のバックグラウンド画像を確認しておくべきである。
RLG の精度を高めるには PSLBG をできるだけ低く, かつその分散を小さくしなければならない。 そのために TLC や凍結動物切片の露光用容器として専用のシールドボックスが市販されている。 試料は IP とコンタクトしてカセットに納め, シールドボックス内で垂直に立てた状態で露光されるようになっている。 これに対して, マイクロプレートをこの状態で露光するとウェル内容物が落下し, 周辺を汚染する恐れが高いので, マイクロプレートを水平に置いた状態で露光する必要がある。 周囲を 20mm の真鍮板で遮へいした容器内で露光した場合の 14C に対する検出限界は 0.05Bq で, 無遮へいの場合 (検出限界: 約 0.1Bq) に比べて検出限界が向上する。 IP を 「無遮へい」, 「カセット」, 5, 10, 20mm の 「真鍮容器」 内で 24 時間露光し, 外周 10mm を除き, 5×5mm の区画 (全部で 2736 区画) の PSLBG25mm2 の分散を検討した結果, PSLOB はシールド容器の厚さに比例して指数関数的に低くなるが, その標準偏差は期待したほど改善できないことが明らかにされている4)。 これは遮へいが厚くなるとバックグラウンド放射線も少なくなるが, 遮へいむらができて, PSLBG の均一性が損なわれるからである。
このように, RLG における検出効率には, 種々の因子が複雑に絡み合い, 露光時間によっても当然 PSL 値は変わってしまう。 そこで, RLG を用いた定量実験の場合には, 標準試料を用意し, 検出効率に影響を及ぼす因子をできるだけ一定にして, 同じ条件で試料調製, 露光, 解析操作を行い, それぞれの PSL 値の比較より壊変率 (Bq) に換算して表示することが望まれる。
1.2. クロストーク
マイクロプレート-RLG では, 一つのウェルに存在する放射能が隣のウェルに存在する放射能の計測に影響を及ぼす (クロストーク) 現象がまず問題となる。 このクロストーク現象を検討するためにマイクロプレートの中央部のウェルの一つに 100Bq の [14C]エイコサペンタエン酸 (EPA) を入れ, 放置乾燥後, 24時間IP と露光し, 隣接したウェルの PSLBG からクロストーク率(%)を求めると, クロストーク率は最大でも 0.1% 未満であり, この値は実用的には問題にならない値であることが明らかにされている5)。
1.3. ウェル内の溶媒除去法
ウェル内の溶媒除去法としては凍結乾燥法と放置乾燥法が考えられる。 不揮発性標識化合物を水含量の多いカラム溶離液で溶出した場合の溶媒除去法として凍結乾燥法を用いると, 標識化合物がウェルの底面に比較的均一に分布し, 再現性のよい結果が得られることが報告されている3)。 しかし, 揮発性の高い標識化合物の場合には標識化合物の逸散が起きてしまうので, 凍結乾燥法は適用できない。 たとえば, 高級脂肪酸の一種である[14C]EPAでも凍結乾燥処理では24時間で約7%ほど揮散し, マイクロプレート上辺部が汚染される。 HPLC-RLG 法など試料個数が多い場合には放置乾燥で十分であると考えられる。 この場合の問題点は乾燥に長時間を要することである。 最近, 6 枚のマイクロプレート(0.2ml水ウェル)を50℃, 約 2 時間で乾燥処理することができる簡便な装置が宝製作所(03-3960-1261)で開発された。 いずれにしても, 溶媒除去後マイクロプレートを IP と露光して得られた PSL 画像をあらかじめ観察し, 測定試料がウェル底面にほぼ均一に広がっていること, およびウェル周辺の部分に汚染が起きていないことを確認する必要がある。
1.4. RLG と液シンとの測定の比較
マイクロプレートのウェルに 0.01 - 100Bq の [14C]EPA 水溶液を 6 試料ずつ取り, 試料の液量が 0.2ml になるように精製水を加え, 放置乾燥後 RLG による測定を, またバイアルに同量の試料を取り, 液シンでそれぞれ 1, 3, 10 分間測定し, 両測定法の比較が行われた5)。 実験結果を表 1 に示した。 表中の下線は, 〔バックグラウンド試料の平均値〕+〔その標準偏差の 3 倍〕を超える PSL 値あるいは測定値を与える放射能の量を検出限界としたときの, 各測定条件における検出限界を示している。 RLG の検出限界は 5×10-2Bq で, これは液シンで 10 分間測定した場合の結果と同じになる。
放射能の測定精度は測定時間の平方根に比例して向上するが, 1 日当たり処理しなければならない試料数の要求から液シンによる測定時間は一般に 1 試料当たり普通 1 - 3 分間で, 長くても 10 分間である。 RLG における PSLOB は露光時間とともに大きくなるが, 露光時間があまり長いのも非実用的であり, 標準的な操作では 24 時間の露光が妥当であると考えられる。
液シンで得られる計数率の変動係数は, 放射能の量が少なくなるにつれて, また測定時間が短くなるにつれて大きくなる。 これは, 放射性壊変の統計変動によるためである。 興味深いことは, RLG における PSLOBの変動係数は放射能の量に無関係でほぼ一定 (0.9 - 2.2) であることである。 これは, 露光 (測定) 時間が長いので, 検討している放射能の量では放射性壊変の絶対数が統計変動を無視できるくらい大きくなること, PSLBG そのものは高いが, その変動係数が小さいことの二つの理由による。 液シンのバックグラウンドは約 30cpm で, これは 0.5Bq の 14C の net cpm に相当し, 1, 3, 10 分間計測時の標準偏差はそれぞれ約 0.10, 0.06, 0.01Bq の cpm に相当する。 これに対して, PSLBG は約 2Bq の 14C の net PSL に相当するが, その標準偏差は約 0.02Bq に相当し, かなり小さい。 このことが, RLG では低レベルの測定試料でも高い精度で測定できる理由の一つと考えられる。
1.5. 14C 以外の核種のマイクロプレート - RLG 法への応用
以上 14C を例としてマイクロプレート-RLG 法について述べてきた。 この手法は IP が応答を示すすべての核種に適用可能であるが, エネルギーの小さいβ線放出核種である 3H, エネルギーの大きいβ線核種である 32P を用いるときには次のような注意が必要である。
3H から放出されるβ線のエネルギーは 0.0186MeV であり, 最大飛程は 0.6mg/cm2 で, これは標準状態にある約 5mm の空気層に相当する。 すなわち, 3H は 14C 用マイクロプレートを使用してもそのままでは測定できない。 14C用マイクロプレートと, そのウェルに相当する部分を開口したスペーサを用い, ヘリウム気流中で 3H 測定用 IP (BAS-TR2040) と露光することによって, 3H も IP を汚染することなく測定でき, その場合の検出限界は 1.0Bq 前後であることが明らかにされている6)。 ヘリウムガスで置換するには IP と測定試料をコンタクトした状態で収納した露光容器を大きなビニル袋に入れ, 袋の中の空気を押し出し, 次にビニル袋をヘリウムで膨らませ, ゴムバンドで密封し, 最後に露光容器の排気パイプを通してゆっくり減圧にすると露光容器内の空気はヘリウムに置き換わる。 また, 排気パイプと給気パイプをつけた露光容器を用いれば, 露光期間中給気パイプを通してヘリウムを少量ずつ流すこともできる。
32P はエネルギーの高いβ線 (1.71MeV) を放射する。 すなわち, 14C 用マイクロプレートではβ線はウェルの側壁を透過し, 著しいクロストークを引き起こす。 そこで, 32P の測定に対して, ウェル間にコリメーターがはめ込まれるような構造のマイクロプレートが考案された。 半径 5.65mm の穴を 5mm 間隔で開けた厚さ 5mm の真鍮板と, ちょうどこの穴にはめ込まれる大きさの, 底の厚さが 0.5mm のプラスチック製試料皿を使用することにより 32P が測定できることが証明された7)。 この場合の 32P の検出限界はきわめて高く, 24 時間露光で 6×10-3Bq であった。 この検出限界は, 液シンで注意深く測定された場合の検出限界の 1 桁以上も低い。 このことは, 32P の測定を液シンから本法に切り換えることによって, 実質上 10 倍以上も大量の 32P を使用したのと同じ成果が挙げられることを意味している。 もう一つの利点は減衰による測定値の補正が不要なことである。 32P の測定では減衰が意外と無視できない誤差を与える。 たとば, 一連の測定試料を 1 日がかりで測定した場合を考えてみると, 減衰を補正しなかった場合には, 最後に測定した試料の計数率は, 減衰分である 4.8% も低く見積もってしまうことになる。
2. マイクロプレート-RLG のラジオ高速液体クロマトグラフィへの応用
マイクロプレート-RLG が最も有効に適用されるのはラジオ HPLC のオフライン測定に対してである。 まず, ラジオ HPLC の概要について解説し, 次にマイクロプレート-RLG を HPLC 溶離液中の放射能の測定に応用するための基礎的検討結果について紹介する。
2.1. オンライン測定法とオフライン測定法
HPLC の溶離液中の放射能の測定法としては, 大別するとオンライン測定法8)とオフライン測定法9)がある。
オンライン測定法は, カラム溶離液に液体シンチレータを混合した後, 光電子増倍管の間に置かれたセル内を通過させ連続的に測定を行う均一測定法 (homogeneous counting method) とカラム溶離液を固体シンチレータを充填したセル内を通過させ連続的に測定する不均一測定法 (heterogeneous counting method) に分けられる。 前者にはシンチレータ廃液の処理の問題などが, 後者には検出効率が低いこと, 放射性物質が固体シンチレータへ吸着する恐れがあるなどの問題が存在する。 いずれの方法においても, 測定時間を長くするためにはセルの容量を大きくする必要があり, 必然的に分離能は低下してしまう。 逆に分離能を高くするためにセルの容量を小さくすると測定時間は短くなるという矛盾点を含んでいる。
この矛盾点を改良するために, 複数個のセルを直線的に配列し, 各セルからの信号を物質の移動速度と同期しながら加算する同期加算型放射能検出器 (synchronized accumulating radioisotope detector, SARD) が考案されている10)。
オフライン測定法はカラム溶離液をフラクションコレクタなどを用い一定時間ごとに分画し, 分画中の放射能を液シンなどで測定する方法である。 分離能を高くするために分画数を多くすると放射能の測定時間が長くなり, 液シン廃液の処理の問題が生ずるという欠点がある。
このようにラジオ HPLC においては放射能の検出感度と分離能の間には矛盾点が存在する。 オフライン測定法ではクロマトグラム中で最もシャープなピークが三つの分画に入るようにするのが最も妥当であると考えられる。 これ以上細かく分画しても分離能の向上は期待できない11)。
2.2. HPLC-RLG の再現性, 検出感度,直線性
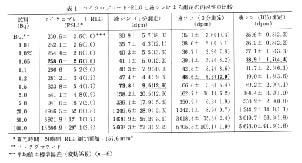
[14C]EPA 溶液 (5.16Bq/μl) 3μl を HPLC (移動相: CH3CN: H2O: TFA=85: 15: 0.1 (v/v), 流速: 1.0ml/min) に 5 回注入し, HPLC 溶離液をフラクションコレクタを用いて 10 秒間隔でマイクロプレートのウェルに直接分画し, 放置乾燥後 IP と 24 時間露光し, RLG により分析が行われた5)。 得られたラジオルミノグラムおよび得られた PSL 値とフラクションの関係から作成したラジオ HPLC クロマトグラムの一例を図 1 に示した。 この実験において測定値の平均値 (n=5) の変動係数が 2.0% であることから, HPLC のオフライン測定法として RLG を使用することにより, 再現性の高い測定が行えることが明らかにされた。
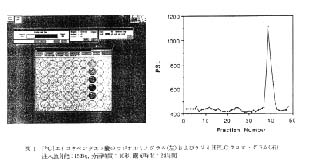
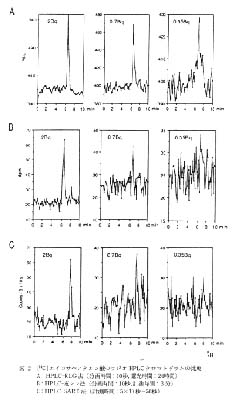
次に, 20, 10, 5, 2, 0.7, 0.35Bq の [14C]EPA をそれぞれ HPLC に 3 回ずつ注入し, 溶離液中の放射能が液シン (HPLC-液シン法), SARD(HPLC-SARD 法) および RLG(HPLC-RLG 法) により求められた。 HPLC-液シン法では 10 秒間隔で分画した溶離液を直接ミニバイアルに分画しシンチレータ 2ml を加え 3 分間測定が行われた。 HPLC-SARD 法では溶離液に親水性シンチレータ 5ml を混合し SARD によりトータルで 50 秒の測定が行われた。 HPLC-RLG 法では, 溶離液を 10 秒間隔で分画した溶離液を直接マイクロプレートのウェルに分画し放置乾燥し, IP と 24 時間露光後 BAS により解析が行われた。
得られた計数あるいは PSL 値とフラクションの関係から作成したラジオ HPLC クロマトグラムの各一例を図 2 に示した。 シグナル/ノイズ比 2 をピークの検出限界とすると,HPLC-液シン法では注入放射能で 0.7Bqが,HPLC- SARD 法では注入放射能で 2Bq が検出限界となる。 これに対して HPLC-RLG 法では, 実験で用いられた最低量の注入放射能である 0.35Bq でも十分にピークとして検出することが可能である。 HPLC-RLG 法で得られたピークの検出限界 0.35Bq は従来のラジオ HPLC では到達できなかった値である。
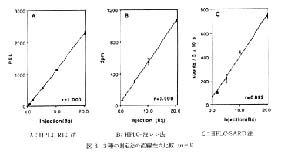
注入放射能とバックグラウンドを差し引いた後のピークの総 PSL 値あるいは総計数との間の直線性について検討し, 得られた結果を図 3 に示した。 HPLC-液シン法では 0.7 - 20Bq の範囲 (相関係数: 0.999) で, HPLC-SARD 法では 2 - 20Bq の範囲 (相関係数: 0.992) で直線関係が成立しているのに対し, HPLC-RLG 法では 0.35-20Bq の全範囲 (相関係数: 1.000) で直線性が成立している。
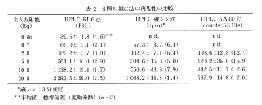
表 2 には三つの測定法の再現性についての結果を示した。 HPLC-RLG 法における変動係数 (1.7 - 4.6) は, HPLC-液シン法の変動係数 (1.4 - 7.9) および HPLC-SARD 法の変動係数 (2.0 - 15.9) に比較して小さいことから, 再現性高く測定が行われることが明らかとなった。
これらの実験結果は, 前述したように HPLC-RLG 法では HPLC-液シン法における 10 分間測定に相当する精度が得られること, 本実験において HPLC-液シン法で採用した測定時間は 3 分間, HPLC-SARD 法によるオンライン測定の測定時間はトータルで 50 (=5×10) 秒間であることなどから合理的に説明できる。
|
拡大
|
図 1 [14C]エイコサペンタエン酸のラジオルミノグラム(左)およびラジオ HPLC クロマトグラム(右)
注入放射能: 15Bq, 分画時間: 10秒, 露光時間: 24時間 |
|
拡大
|
図 2 [14C]エイコサペンタエン酸のラジオ HPLC クロマトグラムの比較
A: HPLC-RLG 法 (分画時間: 10秒, 露光時間: 24時間)
B: HPLC-液シン法 (分画時間: 10秒, 計測時間: 3 分)
C: HPLC-SARD 法 (計測時間: 5×10 秒=50秒)
A: HPLC-RLG 法
B: HPLC-液シン法
C: HPLC-SARD 法 |
|
拡大
|
表 2 3 種の測定法の再現性の比較 |
|
拡大
|
図 3 3 種の測定法の直線性の比較 (n=3) |
3. HPLC-RLG 法の応用例
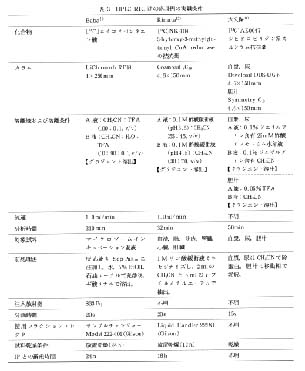
HPLC-RLG 法を代謝研究に利用したいくつかの報告例があり, その実験法の概略を表 3 に, また代謝研究に用いられた化合物の構造式を図 4 に示した。 核種としてはいずれも 14C が用いられているので, ルミラー膜などを介してマイクロプレートと IP が露光されている。 フラクションの間隔は 15 および 20 秒であり, それほど分画時間に差はない。 IP の検索後, 再構成されたクロマトグラムの例を図 5 - 7 に示した。 ラジオ HPLC クロマトグラムの縦軸の単位の表示法は各報告で異なっている。 そこで, 著者が単位の表示法を統一し, さらに図 5 には Bq 換算値を追加した。
EPA とラット肝ミクロゾームのインキュベーション実験5)では, 反応開始 5 分後のラジオ HPLC クロマトグラムよりすでに代謝が進行していることが明らかである。 それぞれのピークは質量分析法により構造が解析された。 その結果, インキュベーション 5 分後にはすでにエポキシ体 (Fr.no. 300 - 500) が生成し, 時間が経過するにつれて基質やエポキシ体が消失し, ジヒドロキシ体 (Fr.no. 50 - 250) が増加してくることが明らかになった。 この実験では 576 個の分画に対する PSL 値の読取りは Ray test 社の TINA system を使用し, IP の読取りエリアの設定と同時にラジオルミノグラムが直接描かれるようになっている。
HPLC-RLG 法は, 測定経費を気にせずに分画時間を短く設定できるので HPLC の分離能を活かしたラジオ HPLC クロマトグラムが得られる。 もし, この実験において HPLC-RLG 法で得られたのと同程度のラジオ HPLC クロマトグラムを HPLC-液シン法で得ようとすると, 576 本の液シン用バイアルと約 31 の液体シンチレータが必要であり, 1 台の液シンを約 1 週間独占的に使用しなければならず, あとに液シン廃液の処理という厄介な仕事が残ることになる。 従来, 薬物の血中動態は全放射能により論じられることが多かったが, HPLC-RLG 法を用いることにより各代謝物の経時変化で論ずることができるようになることを意味している。
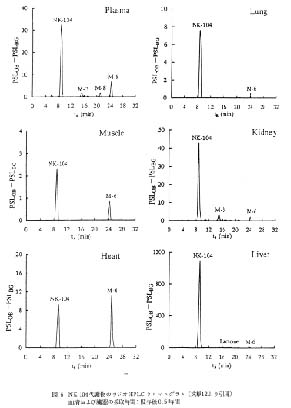
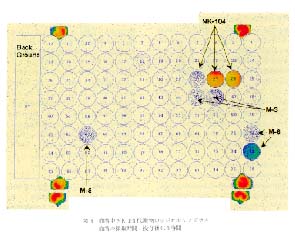
(+)monocalcium bis{(3R, 5S, 6E)-7-〔2-cyclopropyl-4-(4-fluorophenyl)-3-quinolyl〕-3,5-dihydroxy-6-heptenoate} (以下, NK-104) の代謝研究では12), [14C]NK-104 を経口投与し, ラットより経時的に得られた血液および血清中の総放射能が, マイクロプレートのウェル内に採取された試料を凍結乾燥後マイクロプレー ト-RLGにより求められている。さらに,[14C]NK-104 を経口投与し, 5 分後に得られた血清, 肝臓などの生体試料を抽出操作し, HPLC-RLG 法によって試料中の代謝物の量的割合が求められている。 図 8 には血清中の代謝物を HPLC で分離した後に得られたラジオルミノグラムの例を示した。 血清中では未変化体の NK-104 の他に, 5 位の水酸基がケトンとなった 5-keto NK-104(M-3), 側鎖の 酸化を受けた pentanoic acid 誘導体 (M-6), 側鎖の 酸化がさらに進行した propenoic acid 誘導体 (M-8) が認められている。 未変化体である NK-104 は他のすべての臓器のラジオ HPLC クロマトグラムにおいて検出されている。 ラジオ HPLC クロマトグラムは示されていないが, 各代謝物の量的経時変化を追跡した結果, 6 時間後においても心臓と筋肉以外の臓器と血清においては他の代謝物に比較して NK-104 の割合が多いことから, NK-104 は生体内で代謝を受けにくいことが明らかとされている。 図 6 のラジオ HPLC クロマトグラムの中でピークとして判断できるピークの最も低い PSLOB-PSLBG の値は 1 程度である (筋肉のラジオ HPLC クロマトグラムにおける M-6)。 IP との露光時間などが異なるので正確な推定は不可能であるが, このピークに対応する放射能は 0.5Bq 以下と予想される。 また, この方法により NK-104 の連続投与時における血清, 臓器中, 尿中および糞中の代謝物の検索が行われている13)。 9 回連続投与時の 0.5 時間後では血清中の NK-104 の濃度は, 単回投与時の 0.5 時間後に比較して 1.5 倍高くなるが 72 時間および 144 時間後には NK-104 は検出されない, また尿中および糞中の代謝物の検索の結果, 単回投与時の血清および臓器中には認められなかった propanoic acid 誘導体の taurine 抱合体が尿中および糞中に存在することなどが明らかにされている。
|
拡大
|
表 3 HPLC-RLG 法の応用例の実験条件 |
|
拡大
|
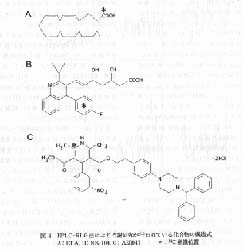
図 4 HPLC-RLG 法により代謝研究が行われている化合物の構造式
A: EPA, B: NK-104, C: AE0047 *: 14C 標識位置 |
|
拡大
|
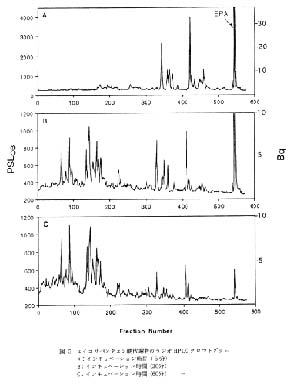
図 5 エイコサペンタエン酸代謝物のラジオ HPLC クロマトグラム
A: インキュベーション時間 ( 5 分)
B: インキュベーション時間 (20分)
C: インキュベーション時間 (60分) |
|
拡大
|
図 6 NK-104 代謝物のラジオ HPLC クロマトグラム (文献12より引用)
血清および臓器の採取時間: 投与後 0.5 時間 |
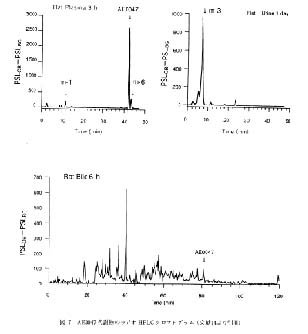
(±)-2-〔4-(benzhydryl-1-piperazin-1-yl)-phenyl〕ethylmethyl 1,4-dihydro-2,6-dimethyl-4- (3-nitrophenyl)-pyridine-3,5-dicarboxylate dihydrochloride (以下, AE0047) の代謝研究では14), [14C]AE0047 をラットに経口投与し 3 時間後に得られた血清中の代謝物, 投与 24 時間以内に排泄された尿中の代謝物および投与 6 時間までの胆汁中の代謝物を HPLC-RLG 法で検索し, 得られたラジオ HPLC クロマトグラムの例が紹介されている (図 7 )。 血清中のラジオ HPLC クロマトグラムにおいては未変化の AE0047 の他にジヒドロピリジン環が酸化された m-6, 側鎖ベンズヒドリル-ピペラジニル-フェニルエチル基が加水分解された m-1 が検出されている。 24 時間以内に排泄された尿中には未変化体は検出されず, m-1 のジヒドロピリジン環の 2 位メチル基が水酸化された m-3 が主代謝物であることが明らかにされている。 胆汁中の代謝物の検索結果, 胆汁中の全放射能に占める未変化体の割合は 1 %以下であり, 他に多くの放射能ピークが認められている。 いずれの代謝研究においても, 保持時間が 2 分程度異なれば二つのピークが分別可能である。
|
拡大
|
図 7 AE0047 代謝物のラジオ HPLC クロマトグラム (文献14より引用) |
|
拡大
|
図 8 血清中 NK-104 代謝物のラジオルミノグラム
血清の採取時間: 投与後 0.5 時間 |
以上 HPLC-RLG 法を代謝研究に利用している例について概説したが, 本法を使用するに当たり常に念頭においていなければならないことは, 注入した全放射能の何%がクロマト上でピークとして出現しているかということである。 これを確かめるためには, カラムに注入した放射能の, たとえば 1/100 をマイクロプレートにとり, その PSL 値を基準にしてラジオ HPLC クロマトグラム上のおのおののピークの PSL 値の合計と比較することにより推定することができる。 また, TLC に比べればはるかに確率は小さいが, 同じ保持時間を有する二つ以上の物質が分別されていない恐れもある。 念のために, ルーチン分析に入る前に各ピークに相当するウェルから試料を回収し, TLC または異なった条件で HPLC 分析し, その単一性を確認しておく慎重さが望まれる。
謝 辞
本論文を執筆するに当たり, 資料を提供していただき, また貴重なご意見を賜りました東京薬科大学, 馬場茂雄名誉教授および興和株式会社, 木全秀樹博士に深謝いたします。
文 献
1) Amemiya, Y. and Miyahara, J.: Nature, 336, 89 (1988)
2) 高橋千太郎, 井尻憲一, 栗原紀夫: Radioisotopes, 44, 637 (1995)
3) Baba, S., Kimata, H., Haruki, S. and Shinohara, Y.: Appl. Radiat. Isot., 44, 1011 (1993)
4) 馬場茂雄: Radioisotopes, 48, 352 (1999); 馬場茂雄: 薬物動態, 14, 42 (1999)
5) Baba, S., Terazawa, Y., Kimata, H., Shinohara, Y., Akira, K. and Hasegawa, Y.: J. Chromatogr., 663, 35 (1994)
6) 馬場茂雄, 堀江正信, 長谷川 弘, 春木左千夫, 木全秀樹: 日本薬学会 第114年会, 1994年 3 月
7) Baba, S., Horie, M., Asahara, N., Shiba, Y., Tomisawa, H. and Tateishi, M.: Appl. Radiat. Isot., 49, 35 (1998)
8) Sjoberg, S. D. and Agren, C.: Anal. Chem., 36, 1017 (1964)
9) Hunt, J. A.: Anal. Biochem., 23, 289 (1968)
10) Baba, S., Suzuki, Y., Sasaki, Y. and Horie, M.: J. Chromatogr., 392, 157 (1987)
11) Reeve, D. R. and Crozier, A. J.: ibid., 137, 271 (1977); Kein, F. K. and Hunt, A.: Appl. Radiat. Isot., 32, 669 (1981)
12) Kimata, H., Fujino, H., Koide, T., Yamada, Y., Tsunenari, Y. and Yanagawa, Y.: Xenob. Metab. Disp., 13, 484 (1998)
13) Fujino, H., Tunenari, Y., Koide, T., Yonemi-Tsu, M., Yanagawa, Y. and Kimata, H.: ibid., 13, 499 (1998)
14) 大久保雅啓, 平田 崇, 十亀祥久, 田中幹雄, 岡野周充, 津田良夫: 薬物動態, 12, 178 (1997)
|

